

| ||
| ||


科目:高中化学 来源: 题型:
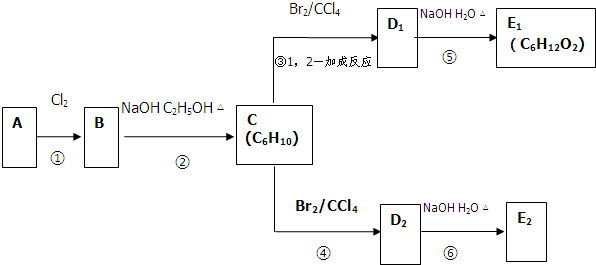
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛( )和邻羟基苯甲醛( )和邻羟基苯甲醛(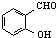 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com