
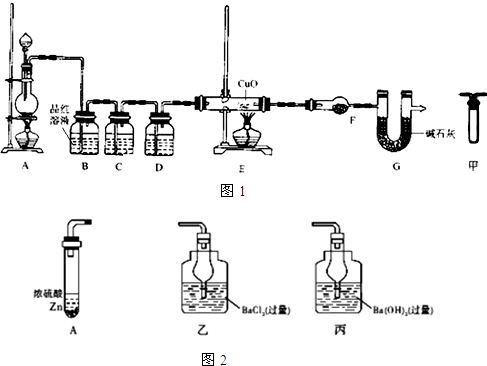
分析 实验Ⅰ、取65.0g锌粒与98%的浓H2SO4(ρ=1.84g•mL-1)110m充分反应,锌全部溶解,对于制得的气体可能生成二氧化硫和氢气;
(1)足量锌与18.4mol•L-1浓硫酸的反应,随反应进行浓硫酸变稀后,锌和稀硫酸反应生成氢气;
(2)A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验;A、B间应增加图中的甲装置是安全装置防止倒吸的作用;
实验Ⅱ、(1)A产生的气体为二氧化硫和氢气,通入某溶液并测 定生成沉淀的质量,需要和二氧化碳反应生成沉淀,乙不与二氧化硫反应,丙和二氧化硫反应生成亚硫酸钡沉淀;
(2)锌过量,随反应进行,浓硫酸浓度减小变为稀硫酸后和锌反应生成的气体为氢气,可以利用氢气把二氧化硫全部排出;
解答 解:实验I、(1)随着硫酸浓度降低,锌与稀硫酸反应生成氢气,所以化学小组所制得的气体中混有的主要杂质气体可能是氢气,
故答案为:H2;随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4═ZnSO4+H2↑;
(2)①C装置是除去二氧化硫,可以用氢氧化钠(或KMnO4)等碱液吸收;D装置是浓硫酸,吸水干燥作用,
故答案为:NaOH溶液;浓硫酸;
②F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验,
故答案为:无水硫酸铜,防止空气中H2O进入干燥管而影响杂质气体的检验;
③A、B间应增加图中的甲装置是安全装置防止倒吸的作用,故答案为:防止倒吸;
实验Ⅱ、为了定量测定浓硫酸具有强氧化性的最低浓度,设计的实验方案为:取18.4mol•L-1浓硫酸aml与足量的锌于A中反应,将生成的气体通入某溶液并测定生成沉淀的质量,
(1)A产生的气体为二氧化硫和氢气,通入某溶液并测 定生成沉淀的质量,需要和二氧化碳反应生成沉淀,乙不与二氧化硫反应,丙和二氧化硫反应生成亚硫酸钡沉淀,
故答案为:丙;
(2)锌过量,随反应进行,浓硫酸浓度减小变为稀硫酸后和锌反应生成的气体为氢气,可以利用氢气把二氧化硫全部排出,不需要增加装置将反应生成的SO2全部排出的操作,
故答案为:后产生的氢气会将其二氧化硫全部排入丙中.
点评 本题考查了浓硫酸的性质分析和实验验证方法,过量锌和浓硫酸反应生成的气体是二氧化硫和氢气是分析关键,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔是衡量物质中含有6.02×1023个结构微粒集体多少的物理量的单位 | |
| B. | 物质的量是2 mol的氢与4 g氦的质量相同 | |
| C. | 1 mol H2的体积是22.4 L,因此H2的摩尔体积是22.4 L/mol | |
| D. | H2的摩尔质量等于NA个氢分子的质量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际上七个基本物理量之一 | |
| B. | 同温同压下,不同气体的气体摩尔体积都约为22.4L/mol | |
| C. | 常温常压下,18gH2O含有的分子数约为6.02×1023个 | |
| D. | 6.02×1023称为阿伏加德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 所有的有机物都很容易燃烧 | |
| C. | 有机物不一定都不溶于水 | |
| D. | 易溶于酒精、苯等有机溶剂中的物质一定是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 标准状况下,22.4LO2含分子数为NA | |
| D. | 标准状况下,8gH2O的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | 氧化物对应的水化物的酸性:G一定强于F | |
| B. | 简单离子的半径:F>G>C>D | |
| C. | 1mol EC2中含2mol E-C键 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0△S>0 | |
| C. | 等浓度的系列稀溶液:①硫酸氢钠②乙酸钠③醋酸④碳酸氢钠,它们的PH由小到大排列的为③①④② | |
| D. | 0.1mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)═2 c(H2SO3)+c(HSO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com