
| A. | 6和8 | B. | 20和17 | C. | 14和8 | D. | 6和16 |
分析 根据物质的化学式为AB2,可判断A的化合价可能为+2价或+4价,B的化合价可能为-1价或-2价,根据常见元素的化合价以及在固态时为原子晶体进行推断.
解答 解:A、原子序数为为6的元素为C,原子序数为8的元素为O,二者组成CO2,为分子晶体,故A错误;
B、原子序数为20的元素为Ca,原子序数为17的元素为Cl,二者组成CaCl2,为离子晶体,故B错误;
C、原子序数为14的元素为Si,原子序数为8的元素为O,二者组成SiO2,为原子晶体,故C正确;
D、原子序数为为6的元素为C,原子序数为16的元素为S,二者组成SO2,为分子晶体,故D错误.
故选C.
点评 本题考查AB2型物质的推断,题目难度不大,注意从化合价和原子晶体的角度分析.


科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:
某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子:S-2 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氢氧根的电子式: | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 氢键属于化学键,但比较弱 | |
| C. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| D. | 共价化合物中一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
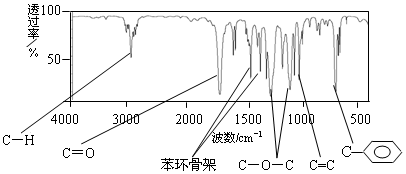
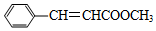 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在白磷(P4)晶体中,P原子与P-P键数目比为2:3 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.
如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com