

分析 (1)使用催化剂通过改变反应的历程,降低反应的活化能,增加了活化分子数目及其百分含量而加快反应速率;
(2)依据图1写出反应的热化学方程式,依据热化学方程式计算生成0.75mol/L×2L=1.5mol乙醇放出的热量;
(3)根据起始量和平衡量计算转化率.
解答 解:(1)使用催化剂通过改变反应的历程,降低反应的活化能,增加了活化分子数目及其百分含量而加快反应速率;
故选:A;
(2)依据图1写出反应的热化学方程式:CO(g)+2H2(g)?CH3OH(g)△H=-91KJ/mol,
依据图2可知反应达到平衡时生成乙醇0.75mol,反应热为:91KJ/mol×0.75mol=68.25KJ/mol,放出热量68.25KJ;
故答案为:68.25;
(3)将2molCO和6molH2充入1L的密闭容器中,则起始时c(CO)=2mol/L,达到平衡状态时,测得c(CO)=0.2mol•L-1,
则CO的转化率为$\frac{2-0.2}{2}×100%$=90%,
故答案为:90%.
点评 本题考查化学平衡移动及其计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,本题注意外界条件对平衡移动的影响.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为吸热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点 v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

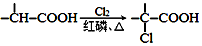

 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
. 为原料制取
为原料制取  的合成路线图.合成路线图示例如下:
的合成路线图.合成路线图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com