
| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
分析 根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,再结合M=$\frac{m}{n}$计算气体摩尔质量,根据元素质量分数计算分子中C、H原子数目,进而确定分子式.
解答 解:标况下,11.2L气体烃的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,
该气态烃的摩尔质量=$\frac{14g}{0.5mol}$=28g/mol,
烃分子中C原子数目=$\frac{28×85.7%}{12}$=2,H原子数目=$\frac{28-12×2}{1}$=4,
故烃的分子式为C2H4,
故选A.
点评 本题考查有机物分子式的确定,比较基础,注意掌握用相对分子质量确定烃的分子式方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.1(m+n)g | B. | 14.2g | C. | 17.4g | D. | 20.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
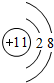
 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.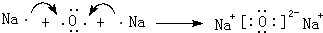 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ②④⑥ | C. | ②④⑤⑥⑦ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
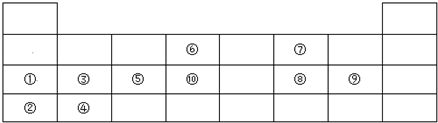
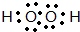 ,⑥与⑨形成的5原子分子的结构式为
,⑥与⑨形成的5原子分子的结构式为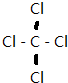 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S+2HNO3═S↓+2NO2↑十2H2O | B. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | ||
| C. | 3FeO+10HNO3═3Fe(NO3)3十5H2O+NO↑ | D. | CuO+2HNO3═3Cu(NO3)2+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com