����⣺��1����2SO
2��g��+O
2��g��
2SO
3��g����H=-196.6kJ?mol
-1��2NO��g��+O
2��g��
2NO
2��g����H=-113.0kJ?mol
-1���ݸ�˹����
�õ��Ȼ�ѧ����ʽΪ��NO
2��g��+SO
2��g��
SO
3��g��+NO��g����H=-41.8KJ/mol��
�ʴ�Ϊ��-41.8��
��2��a����Ӧǰ������������䣬��Ӧ��������ϵѹǿʼ�ձ��ֲ��䣬����֤����Ӧ�ﵽƽ�⣬��a����
b��ƽ����ϵ�ж������������Ǻ���ɫ���壬���������ɫ���ֲ��䣬˵����������Ũ�Ȳ��䣬֤����Ӧ�ﵽƽ�⣬��b��ȷ��
c����Ӧǰ�������������䣬������䣬��Ӧ��������ϵ�������ܶȲ��䣬������ϵ�����ܶȲ��䲻��֤����Ӧ�ﵽƽ�⣬��c����
d��ÿ����1mol SO
3��ͬʱ����1molNO
2��˵����Ӧ������У�����֤����Ӧ�ﵽƽ�⣬��d����
e��SO
3��NO�����֮�ȱ��ֲ��䣬�ڷ�Ӧ������ʼ����1��1������˵����Ӧ�ﵽƽ�⣬��e����
��ѡb��
һ�������£���1molNO
2��2molSO
2�����ܱ������з���������Ӧ��NO
2��g��+SO
2��g��
SO
3��g��+NO��g����H=-41.8KJ/mol�����������Ӧƽ��ʱNO
2��SO
2�����Ϊ1��6�����ݻ�ѧƽ������ʽ��ʽ���㣬����������������ʵ���Ϊx��
NO
2��g��+SO
2��g��
SO
3��g��+NO��g��
��ʼ����mol�� 1 2 0 0
�仯����mol�� x x x x
ƽ������mol��1-x 2-x x x
��1-x������2-x��=1��6
x=0.8mol�����������Ϊ1L��ƽ��Ũ��c��NO
2��=0.2mol/L��c��SO
2��=1.2mol/L��c��SO��=0.8mol/L��c��NO��=0.8mol/L��
��ƽ�ⳣ��K
=
=2.7��
����������ת����=
��100%=80%
�ʴ�Ϊ��b��2.7��80%��
��3����Ӧ����ʽΪCO��g��+2H
2��g��
CH
3OH��g��
�ٸ÷�Ӧ��40���60��ʱ��ƽ�ⳣ���ֱ�ΪK
1��K
2����K
1����K
2��˵���¶�����ƽ�ⳣ����С��ƽ��������У�����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
�ڷ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ����������������ʱ��Ƿ�Ӧ���������֮���������ֵ��
A����Ӧ���������������ﷴӦ�����ȷ�Ӧ����A����
B����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ����������Ӧ�Ļ�ܣ���B��ȷ��
C����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ���ܲ�������Ӧ�Ļ�ܣ���C����
D����Ӧ���������������ﷴӦ�����ȷ�Ӧ����D����
�ʴ�Ϊ��B��
��4��ij�¶�ʱ������ͼ���е�H
2Ũ����ʱ��ı仯���ߣ�����Ũ�ȼ�С��ƽ�ⲻ�䣬�״�Ũ������ƽ�ⲻ�䣬����������Ũ�Ⱥͻ�ѧ����ʽ����״�Ũ�ȵ�������㻭��ͼ��0.01��0.02����0.02��0.04����0.03��0.06������0.04��0.08�����CH
2OHŨ����ʱ��ı仯����Ϊ��
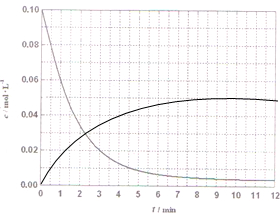
���ʴ�Ϊ��

��

 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮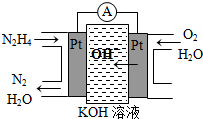 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������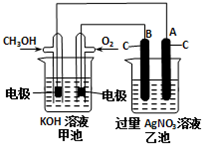 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮