
����Ŀ��ʵ����������������������Ҵ��Ʊ�1��2һ���������װ����ͼ��ʾ��
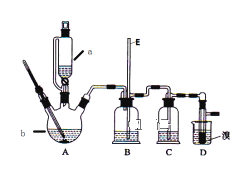
�й������б����£�
�Ҵ� | 1.2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g/cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�밴Ҫ��ش��������⣺
��1��д��Aװ���еĻ�ѧ��Ӧ����ʽ_____��
��2��װ��C��ʢ������������Һ����������_____
��3���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_____
��4���жϸ��Ʊ���Ӧ�Ѿ��������������_____��
��5����������������δ��Ӧ��Br2�������_____ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ��
a ˮ b ���������� c �⻯����Һ d �Ҵ�
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����_____�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____��
���𰸡�CH3CH2OH![]() CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
CH2��CH2+H2O ��ȥ����CO2��SO2 ���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ� �۲�D����ɫ�Ƿ���ȫ��ȥ b ����������ӷ� ��Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶���������
��������
ʵ�����Ʊ�1��2-�������飺������ƿA�з�����Ӧ���Ҵ���Ũ����������·�����������ˮ��ȡ��ϩ���Ҵ���������ȥ��Ӧ����Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)
CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ�����Ӧ����ʽΪ��CH3CH2OH+4H2SO4(Ũ)![]() 4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������Ӧ��SO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2-�������飬��ӦΪ��CH2=CH2+Br-Br��CH2Br-CH2Br���Ƶ�1��2-�������顣
��1��������������֪��װ��A�еĻ�ѧ��Ӧ����ʽΪ��CH3CH2OH![]() CH2=CH2��+H2O��
CH2=CH2��+H2O��
��2��������������֪��װ��C������Ϊ����ȥ����CO2��SO2��
��3���Ҵ���140��ʱ����ȡ����Ӧ�������ѣ�����������ϩ�������٣��ʴ�Ϊ�����ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ�
��4����ϩ���巢���ӳɷ�Ӧ��ʹ��ˮ��ɫ������۲쵽D����ɫ��ȫ��ȥ��˵�����Ʊ���Ӧ�Ѿ��������ʴ�Ϊ���۲�D����ɫ�Ƿ���ȫ��ȥ��
��5������ˮ�е��ܽ�Ƚ�С���������ǿ�����ԣ���������ԭ�����ʣ��⼸������ֻ�����������ܱ�����������ѡb��
��6�����ж����ӷ������Է�Ӧ������Ӧ����ˮ��ȴװ��D����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܣ��ʴ�Ϊ����Ʒ1��2һ����������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�Ƚϸ���![]() ���������ǿ����
���������ǿ����![]() ________
________![]() ���>����<����=��������һ����ѧ����ʽ˵��
���>����<����=��������һ����ѧ����ʽ˵��![]() ��
��![]() ���
���![]() ���������ǿ��________��
���������ǿ��________��
(2)![]() �����ӻ������ԭ�Ӿ�����8�����ȶ��ṹ��д��
�����ӻ������ԭ�Ӿ�����8�����ȶ��ṹ��д��![]() �ĵ���ʽ________��
�ĵ���ʽ________��
(3)�ڳ�ѹ�£��״��ķе㣨65�棩�ȼ�ȩ�ķе㣨-19�棩�ߡ���Ҫԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NA�ǰ����ӵ�������ֵ������˵��������ǣ� ��
A.��״����0.5mol![]() N3
N3![]() T����������������Ϊ6.5NA
T����������������Ϊ6.5NA
B.0.1molFe��0.1molCl2��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.2NA
C.13.35gAlCl3ˮ���γɵ�Al(OH)3����������С��0.1NA
D.һ�������µ��ܱ������У�2molSO2��1molO2����Ӧ��ַ������������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ����
A.���ķ���ʽΪC6H6��������ʹ����KMnO4��Һ��ɫ�����ڱ�����
B.�ӱ��Ŀ�����ʽ(![]() )�����������к���̼̼˫����Ӧ����ϩ��
)�����������к���̼̼˫����Ӧ����ϩ��
C.����ͬϵ���Ƿ����н�����һ��������������������
D.������Ϊƽ���������νṹ��6��̼ԭ��֮��ļۼ���ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ױ�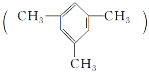 ��һ����ȼ��������ˮ����ˮ�ܶ�С���ж�Һ�壬����Ҫ���л�����ԭ�ϣ������Ʊ��ϳ���֬�����������ȡ�
��һ����ȼ��������ˮ����ˮ�ܶ�С���ж�Һ�壬����Ҫ���л�����ԭ�ϣ������Ʊ��ϳ���֬�����������ȡ�
(1)�����ױ����ڱ���ͬϵ�ѡ��һ���Լ����𱽺;����ױ���________________��
(2)�����ױ������е�һ��Hԭ�ӱ�Clԭ��ȡ�������ò�����________�֡�
(3)�������ڱ���ͬϵ�����________(����ĸ)��
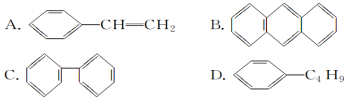
(4)���������У��ܷ����ӳɷ�Ӧ��Ҳ�ܷ���ȡ����Ӧ��ͬʱ��ʹ��ˮ��ӳɷ�Ӧ����ɫ������ʹ���Ը��������Һ��ɫ����________(����ĸ)��
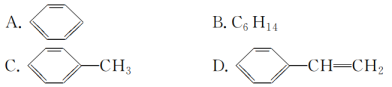
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������£�0.01 mol/L MOH��Һ��pHΪ10��MOH(aq)��H2SO4(aq)��Ӧ����1 mol���ε���H����24.2 kJ��mol��1��ǿ����ǿ���ϡ��Һ���к���Ϊ��H����57.3 kJ��mol��1����MOH��ˮ��Һ�е������HΪ( )
A. ��69.4 kJ��mol��1 B. ��45.2 kJ��mol��1
C. ��69.4 kJ��mol��1 D. ��45.2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��H��Ϊ��ѧ��ѧ�г��������ʣ�A��B��HΪ���壬��Ӧ������Ҫ�Ĺ�ҵ��Ӧ������֮��������ת����ϵ(��Ӧ�����ɵ�ˮ����ȥ)��

��ش��������⣺
��1��B��_____��D��_____��G��_____��H��_____(�ѧʽ)��
��2����ҵ�ϳ����÷�Ӧ����ȡƯ�ۣ��÷�Ӧ�Ļ�ѧ����ʽ��__________��Ư������ˮ���ܿ����е�CO2���ã���������Ư�ס�ɱ�����õĴ����ᣬ��ѧ��Ӧ����ʽΪ_________��
��3��A��Ԫ�ص�ԭ�ӽṹʾ��ͼΪ________��
��4��F����Һ�еĵ��뷽��ʽΪ_________��
��5��������Ӧ������������ԭ��Ӧ����_______(��д���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�Ĺ����ŷſɶԺ�����������滷����ɺܴ�Ӱ�죬��ԭ������ͼ��ʾ�����������������
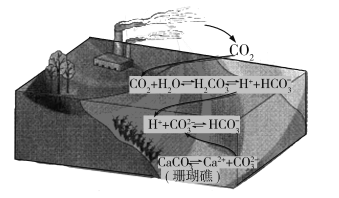
A.��ˮ�ữ������![]() Ũ������
Ũ������![]() Ũ�ȼ�С
Ũ�ȼ�С
B.��ˮ�ữ�ܴٽ�CaCO3���ܽ⣬����ɺ��������
C.CO2������ˮ�ữ����ԭ��Ϊ![]()
![]() H++
H++![]()
D.ʹ��̫���ܡ����ܵ�����Դ�ɸ���ɺ�������滷��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ʊ������ԭ��Ϊ��NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3�������������գ�
(1)������Ӧ��ϵ�г��ֵļ��ֶ�����Ԫ�أ��ǽ�������ǿ����_____���ڶ�����ԭ�Ӱ뾶�ɴ�С����______��
(2)��Ӧ��ϵ�г��ֵķǽ���Ԫ�ؿ��γɶ��ֻ����� �����к�笠����ӿռ乹����ͬ�������л���ĵ���ʽ��______���÷���Ϊ_____( ѡ���������������Ǽ�����)���ӡ�
(3)д������Ԫ����������δ�ɶԵ��ӵ�ԭ�Ӻ�������Ų�ʽ_____�����й��ڸ�Ԫ�غ���Ԫ��֮��ǽ����Դ�С�ж�������ȷ����____(����)
a.����������Ӧˮ��������� b.��Ԫ���γɻ�����Ļ��ϼ�
c.��̬�⻯����ȶ��� d. �⻯��ˮ��Һ�������
(4)����������ľ���ҲӦ�������ڽ��ʯ����ʵ�ʽ�Ϊ���ӣ���������Ϊ��������������������Ժͷ����������ѱ��ϸ�ִ�С����磺�����ױ�����������ÿ����ԭ�Ӷ��γ��������ÿ��NH3����Χ______��NH3ͨ��������ϡ�
(5)������ FeF3�۵����1000������Fe(CO)5 ���۵�ȴ���� 0����FeF3�۵�Զ����Fe(CO)5��ԭ�������_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com