
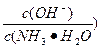 ��ֵ_________(�������С�����䡱)��
��ֵ_________(�������С�����䡱)��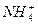 )��c(H+)��c(OH-)
)��c(H+)��c(OH-)
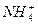 +OH-���淴Ӧ�����ƶ���c(OH-)��С��c(NH3��H2O)����(4)ǡ�÷�Ӧ����NH4Cl��Һ��ˮ�������ԡ�(5)��ˮϡ�͵�500 mL����ҺŨ��Ϊ0.01 mol��L-1����Һ�е�c(H+)=10-2 mol��L-1����Һ�е�c(OH-)=10-12 mol��L-1����Һ�е�OH-�͵���ˮ�������OH-��������Һ����ˮ�������c(H+)=c(OH-)=10-12 mol��L-1��
+OH-���淴Ӧ�����ƶ���c(OH-)��С��c(NH3��H2O)����(4)ǡ�÷�Ӧ����NH4Cl��Һ��ˮ�������ԡ�(5)��ˮϡ�͵�500 mL����ҺŨ��Ϊ0.01 mol��L-1����Һ�е�c(H+)=10-2 mol��L-1����Һ�е�c(OH-)=10-12 mol��L-1����Һ�е�OH-�͵���ˮ�������OH-��������Һ����ˮ�������c(H+)=c(OH-)=10-12 mol��L-1��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�� ��Һ�� ��Һ������  |
B�� ��Һ�У� ��Һ�У�����  |
C�� ��Һ�У� ��Һ�У�����  |
D�� ��Һ�У� ��Һ�У� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B��c(Na+)=2��c( )+c( )+c( )+c(H2CO3)�� )+c(H2CO3)�� |
C��c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3) |
D��c(Na+)=c( )=c(OH-)=c(H+) )=c(OH-)=c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���εĵ���ƽ�ⱻ�ƻ� | B��ˮ�ĵ���̶������� |
| C����Һ��pHһ�������ı� | D��������ˮ�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��c(HN3)>c(H+)>c(N-3)>c(OH-) |
| B��HN3��NH3�������ɵĵ�������ǹ��ۻ����� |
| C��NaN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��c(Na+)>c(N-3)>c(OH-)>c(H+) |
D�� ��CO2����ȵ����� ��CO2����ȵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ˮ���������ˮ���DZ��ʲ�ͬ�ķ�Ӧ |
| B�������ˮ�ⷴӦ�ɿ���������кͷ�Ӧ���淴Ӧ |
| C������Na2S��Һʱ��Ϊ��ֹˮ��ɼ�������NaOH |
| D�������µ������Ũ�ȵĴ����NaOH��Һ��Ϻ���Һ�е�Na+��CH3COO-��Ũ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
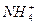 ��Cl-�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��Cl-�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��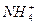 ����c��H+����c��OH-����c��Cl-����c��
����c��H+����c��OH-����c��Cl-����c��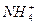 ����c��OH-����c��H+��
����c��OH-����c��H+��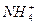 ����c��Cl-����c��OH-����c��H+����c��Cl-����c��H+����c��
����c��Cl-����c��OH-����c��H+����c��Cl-����c��H+����c��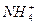 ����c��OH-��
����c��OH-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100mL 0.1mol��L��1 AlCl3��Һ�к���Al3+��ĿΪ0.01NA��NA���������ӵ������� |
| B��Ksp(BaSO4)=1.07��10��10��Ksp(BaCO3)=2.58��10��9�����Բ��ܽ�BaSO4ת��ΪBaCO3 |
| C�������£�pH=11��NaOH��Һ��pH=3��CH3COOH��Һ�������Ϻ���ҺpH<7 |
| D��0.1 mol��L��1 Na2CO3��Һ�У�c(Na+)��c(CO32��)��c(HCO3��)��c(OH��)��c(H+) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com