
在120 ℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后压强没有变化,则该混合烃可能是
A.CH4和C2H4 B.CH4和C2H6
C.C2H4和C2H6 D.C3H4和C3H6
科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L- | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| C(S2O82-)/mol?L- | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为____________________________________________________。
(2)加入碳酸钠调节pH至a,a的范围是_______________________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是___________________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是___________________________。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行_______________操作。
查看答案和解析>>
科目:高中化学 来源:2012届广东省广州六校高三第二次联考化学试卷 题型:填空题
(12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: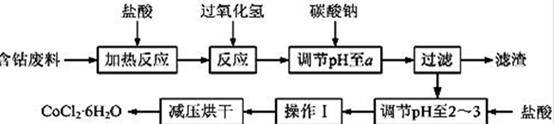
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |

 。
。查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三三月月考(理综)化学部分 题型:填空题
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
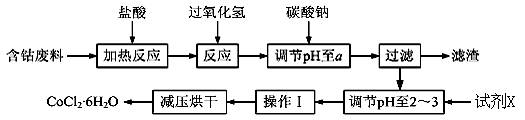
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑[来源:学。科。网]
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 。
(2)加入碳酸钠调节pH至a,a的范围是 ;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为___________。
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (写出两个原因)。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com