
 2SO3(g),根据下表中的数据判断下列图像错误的是
2SO3(g),根据下表中的数据判断下列图像错误的是 | pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:不详 题型:单选题

 B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度 |
| C.t2-t3,反应不再发生 |
| D.t2-t3,X2、Y2、Z2的物质的量浓度之比为1∶3∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
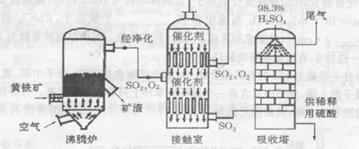
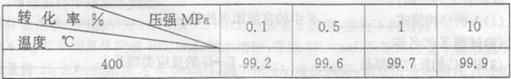
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
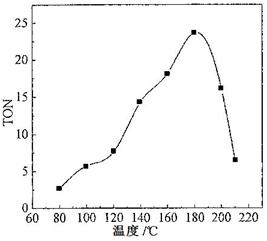
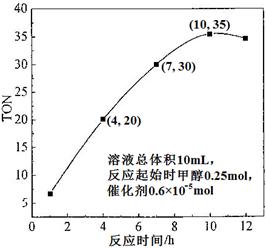
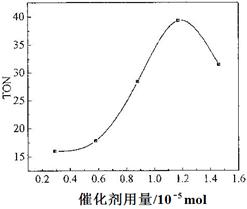
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
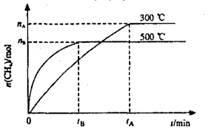
A.101KPa、120℃时,该反应的平衡常数表达式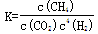 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率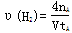 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
| A.850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol·L-1·min-1 |
| B.t1℃高于850℃ |
| C.t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强 |
| D.若t2℃时,各物质的平衡浓度符合c(CO2)·c(H2)=2 [c(CO)·c(H2O)],则t2℃高于850℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com