
| ||
| ||
| ||
| ||
| ||
 ,反应MnO2+4H Cl(浓)
,反应MnO2+4H Cl(浓)
| ||
 ,
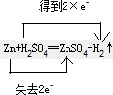
, ;H2SO4;Zn;
;H2SO4;Zn; ;MnO2;HCl;
;MnO2;HCl;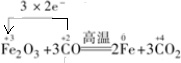 ,
,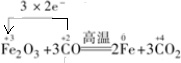 ;Fe2O3;CO.
;Fe2O3;CO.


科目:高中化学 来源: 题型:
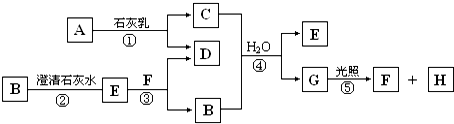
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
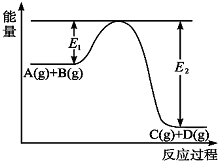 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
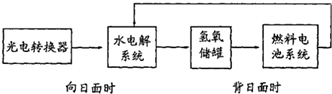 右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )
右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )| A、该能量转化系统工作时,需不断补充H2O |
| B、该转化系统的能量本质上来源于太阳能 |
| C、水电解系统中的阴极反应:4OH--4e-=O2+2H2O |
| D、燃料电池放电时的负极反应:H2-2e-=2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com