
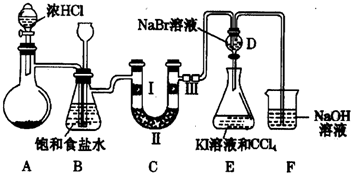
分析 (1)实验室制备氯气是利用二氧化锰固体和浓盐酸加热反应生成氯化锰、氯气和水;依据氯酸钾和浓盐酸反应的化学方程式结合元素化合价变化计算电子转移;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢,用饱和食盐水可以吸收氯化氢;B装置还能够检测实验过程中装置C是否发生堵塞;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)依据氯气氧化性大于溴,能够置换溴,溴的氧化性大于碘,能够置换碘解答;
(5)氯气有毒,直接排放能够引起空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收过量氯气.
解答 解:(1)实验室制取氯气反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
若A装置中固体药品为KClO3,和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,反应生成3molCl2,转移电子5mol,则反应中每生成1mol Cl2时转移电子的物质的量为$\frac{5}{3}$mol,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;$\frac{5}{3}$;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,用饱和食盐水可以吸收氯化氢;
检测实验过程中装置C是否发生堵塞,若C中发生堵塞,会看的,B中长颈漏斗中液面上升,形成液柱;
故答案为:除去氯气中的氯化氢,检测实验过程中装置C是否发生堵塞;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,Ⅱ中应是干燥剂无水氯化钙,湿润的氯气通过干燥除去水分,通过Ⅲ处干燥的有色布条,布条不褪色;
故答案为:无水氯化钙,干燥的有色布条;
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性,使用操作为及现象为:打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘;
故答案为:打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘.
(5)F作用吸收过量氯气,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气实验室制取、氯气性质的检验、实验设计、实验装置的理解评价、化学方程式、离子方程式的书写等,注意装置连接的操作和实验设计,掌握基础是关键,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜在阳极的反应顺序是:Fe-2e-═Fe2+、Ni-2e-═Ni2+、Cu-2e-═Cu2+,杂质金和银不反应形成“阳极泥” | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,阳极有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是:Pb(s)+SO${\;}_{4}^{2-}$(aq)-2e-═PbSO4(s) | |
| B. | 充电时,每消耗1molPbSO4的同时转移2mol电子 | |
| C. | 放电时,该电池的负极材料是铅板 | |
| D. | 充电时,电池中硫酸的浓度不断变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 含氟牙膏可以有效防止龋齿 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下端流出,上层液体从漏斗上口倒出 | |
| B. | 萃取操作是针对互溶的液体物质间物质沸点的不同所进行的分离 | |
| C. | 容量瓶用蒸馏水洗涤后须烘干后才能使用 | |
| D. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com