
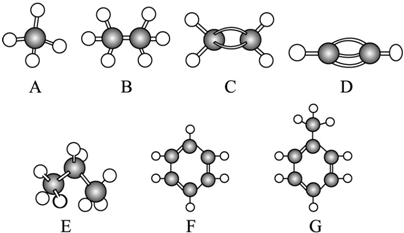

分析 有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,根据物质的组成、结构和性质解答该题.
解答 解:有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,
(1)常温下含碳量最高的气态烃是乙炔,故答案为:D;
(2)能够发生加成的烃有有乙烯、乙炔、苯和甲苯4种,故答案为:CDFG;
(3)一卤代物种类最多的是甲苯,共有4种,故答案为:G;
(4)C为乙烯,可发生加成反应生成聚乙烯,方程式为 ,故答案为:
,故答案为: ;
;
(5)乙炔和氢气在一定条件下发生加成反应可生成乙烯,方程式为HC≡CH+H2$\stackrel{一定条件}{→}$CH2=CH2,
故答案为:HC≡CH+H2$\stackrel{一定条件}{→}$CH2=CH2.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的结构特点,根据结构模型判断有机物的种类,为解答该题的关键.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g Fe参与反应转移的电子数一定为0.2NA | |
| B. | 2.3g Na参与反应转移的电子数一定为0.1NA | |
| C. | 标况下,2.24L Cl2参与反应转移的电子数一定为0.2NA | |
| D. | 标况下,2.24L O2参与反应转移的电子数一定为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
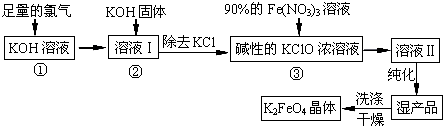
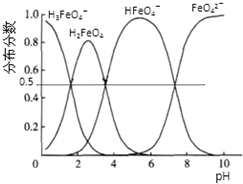
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com