
分析 根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热.
解答 用50mL 0.50mol•L-1盐酸和50mL 0.60mol•L-1 NaOH溶液反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=25.4℃-22.1℃=3.3℃,则生成0.025mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×3.3℃=1379.4J,即1.3794KJ,
所以实验测得的中和热△H=-$\frac{1.3794kJ}{0.025mol}$=-55.2kJ/mol,
故答案为:-55.2 kJ/mol.
点评 本题考查学生有关中和热的测定知识,题目难度不大,注意掌握中和热的计算方法,明确中和热与酸、碱的物质的量无关.


科目:高中化学 来源: 题型:选择题
| A. | c(SO3)=0.4 mol•L-1 | B. | c(SO2)=c(SO3)=0.15 mol•L-1 | ||
| C. | c(SO2)=0.25 mol•L-1 | D. | c(SO2)+c(SO3)=0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在12 g单层石墨中,含六元环的数目为1NA | |
| B. | 50mL 18.4mol•L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA | |
| C. | 42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA | |
| D. | 1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1盐酸,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
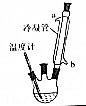 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下: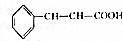 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$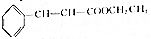 +H2O
+H2O | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 与水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(B)<r(C)<r(D) | |
| B. | 元素B、E的最高价氧化物的水化物都是强酸 | |
| C. | C、D的氧化物都能与氢氧化钠反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 工业上常采用电解法冶炼Y 单质 | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com