
某元素M2+核外电子数为10,该元素是下列原子中的()
A. Cr B. Mg C. Fe D. Ti
科目:高中化学 来源: 题型:
下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用套管实验装置(部分装置未画出)进行的实验,叙述错误的是()
A. 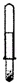
利用此装置可以制取少量H2
B. 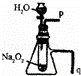
利用此装置可以验证Na2O2与水反应既生成氧气,又放出热量
C. 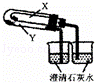
利用此装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
D. 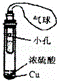
利用此装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用.
(1)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种).
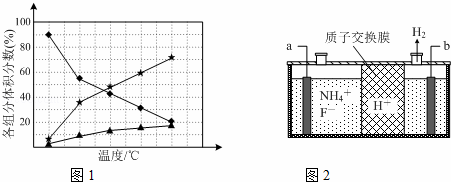
(2)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示.
①氮化硅的化学式为
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R的最高价含氧酸的化学式为HnRO2n﹣2,则在气态氢化物中R元素的化合价为()
A. 12﹣3n B. 3n﹣12 C. 3n﹣10 D. 6﹣3n
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下合成乙烯。
6H2(g)+2CO2(g)  C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
 (1)乙烯是___________分子。(填极性或非极性)
(1)乙烯是___________分子。(填极性或非极性)
(2)请在方程式上标出该反应电子转移的方向和数目。
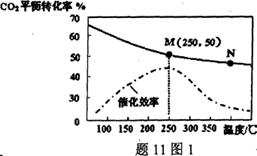
(3)温度对CO2的平衡转化率和催化剂催化效率的影
响如题11图1,下列说法正确的是___________。
A.此反应随温度升高,反应速率一定加快
B.平衡常数:KM>KN
C.M点CO2的平衡转化率受温度、催化剂的共同影响
 (4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
(4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
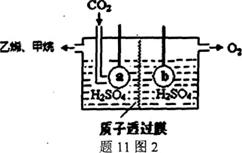
(5)电解法制取乙烯装置如题11图2,电极a接电源的
___________极,生成乙烯的电极反应式为___________。
当左侧有33.6L(标准状况)CO2反应时,左右两侧溶液
质量差|△m右|﹣|△m左|=36g,则乙烯的产率为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com