
| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
分析 (1)甲分子与肼分子具有相同的电子数,二者反应的生成物中有l0e-分子,另一种生成物为极稳定的单质,该单质为氮气,甲具有强氧化性且含有18单质,可推知甲为H2O2,生成10电子分子为H2O;
(2)由盖斯定律可知,④-②得:S(g)+O2(g)=SO2 (g),以此计算△H;
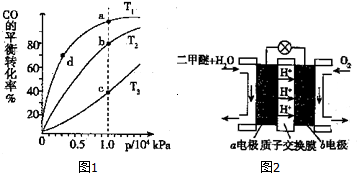
(3)正反应为放热反应,一定压强下,升高温度,平衡向逆反应方向移动,CO的转化率降低,故温度T3>T2>T1,相同温度下,压强越大反应速率越快,相同压强下,温度越高反应速率越快;
在T1℃、1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大;
(4)I处于平衡状态,根据I中数据计算平衡常数,再计算Ⅱ中浓度商Qc,与平衡常数相比判断反应进行方向,进而判断正、逆反应速率相对大小;
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,根据电荷守恒可知有氢离子生成,结合守恒书写;
正极反应为O2+4e-+4H+=2H2O,据此计算通过质子交换膜的质子数;
根据燃烧热计算1mol甲醚完全燃烧放出的热量,再根据电池的工作效率定义计算.
解答 解:(1)甲分子与肼分子具有相同的电子数,二者反应的生成物中有l0e-分子,另一种生成物为极稳定的单质,该单质为氮气,甲具有强氧化性且含有18单质,可推知甲为H2O2,生成10电子分子为H2O,该反应的化学方程式为:N2H4+2H2O2=N2↑+4H2O,
故答案为:N2H4+2H2O2=N2↑+4H2O;
(2)已知:①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1
③2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1l
④2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ•mol-1
根据盖斯定律,④-②得:S(g)+O2(g)=SO2 (g)△H=-574kJ•mol-1,
故答案为:S(g)+O2(g)=SO2 (g)△H=-574kJ•mol-1;
(3)正反应为放热反应,一定压强下,升高温度,平衡向逆反应方向移动,CO的转化率降低,故温度T3>T2>T1,相同压强下,温度越高反应速率越快,故v(a)<v(b)<v(c),d点压强小于a,故反应速率v(d)<v(a),故反应速率v(d)<v(a)<v(b)<v(c);
在T1℃、1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大,得不偿失;
故答案为:v(d)<v(a)<v(b)<v(c);压强为1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大,得不偿失;
(4)I处于平衡状态,则平衡常数k=$\frac{1×1{0}^{-4}×(1×1{0}^{-4})^{3}}{(1×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=1,Ⅱ中浓度商Qc=$\frac{1×1{0}^{-4}×(2×1{0}^{-4})^{3}}{(2×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=2,则Qc>K=1,故反应向逆反应方向进行,故v(正)<v(逆),
故答案为:<;I处于平衡状态,则平衡常数k=$\frac{1×1{0}^{-4}×(1×1{0}^{-4})^{3}}{(1×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=1,Ⅱ中浓度商Qc=$\frac{1×1{0}^{-4}×(2×1{0}^{-4})^{3}}{(2×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=2,则Qc>K=1,故反应向逆反应方向进行;
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳,根据电荷守恒可知有氢离子生成,负极电极反应式为:CH3OCH3-12e-+3H2O═2CO2↑+12H+;
正极反应为O2+4e-+4H+=2H2O,当消耗1molO2时,通过质子交换膜的质子数为4NA;
二甲醚燃烧热为1455kJ/mol,则1mol甲醚完全燃烧放出的热量为1455kJ,若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为$\frac{1320kJ}{1455kJ}$×100%=90.7%,
故答案为:CH3OCH3-12e-+3H2O═2CO2↑+12H+;4;90.7%.
点评 本题属于拼合型题目,涉及无机物推断、热化学方程式书写、化学反应速率因素、化学平衡常数应用、原电池原理及有关计算,侧重考查学生对知识的迁移应用、分析解决问题的能力,化学平衡常数计算及其应用成为高考的常考知识点,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | BaCl2溶液 | C. | 稀H2SO4 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铀元素一定至少还存在一种质量数大于238的同位素,X为中子 | |
| B. | 不能用质量数代替铀的同位素的相对原子质量计算它的近似相对原子质量,X为原子 | |
| C. | 黔U的变化属于化学变化,X为质子 | |
| D. | 铀的几种同位素的化学性质明显不同,X为电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子的结构是长链状的 | |
| B. | 高分子间相互作用的分子间力较强 | |
| C. | 高分子化合物链里的原子是以共价键结合的 | |
| D. | 高分子链之间发生了缠绕 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com