
| A.任何化学反应,只要是放热反应,理论上都能设计成原电池 |
| B.周期表中所有元素都是从自然界中发现的 |
| C.原子结合成分子过程中一定释放出能量 |
| D.需要加热才能发生的反应一定是吸热反应 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
 下列说法正确的是( )
下列说法正确的是( )| A.所有化学变化一定遵循质量守恒和能量守恒 |
| B.所有化学变化的能量都可以通过原电池转化为电能 |
| C.化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
| D.断开旧化学键与形成新化学键之间的能量差只能以热量的形式释放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
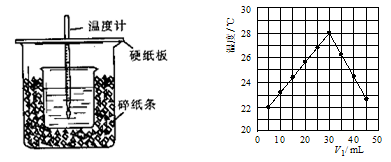
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
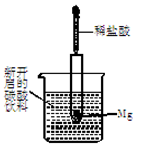
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放出83 kJ热量 | B.吸收183 kJ热量 |
| C.反应总能量低于生成物的总能量 | D.放出183 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com