
【题目】某研究团队实现了电化学合成(又称电解合成)H2O2,该方法的原理如图所示,下列有关说法错误的是( )
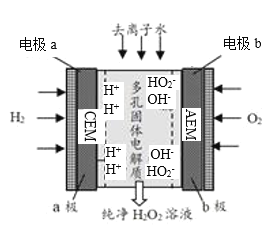
![]()
A.电极a为阳极,CEM为阳离子交换膜
B.该方法是一种制取H2O2的绿色方法
C.电极b上的电极反应式为O2+H+-2e-=HO2-
D.通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度
【答案】C
【解析】
结合图可知,电极a为阳极,H2阳极失电子得H+;电极b为阴极,O2在阴极得电子得HO2-,HO2-和H+分别穿过AEM、CEM在多孔固体电解质内结合生成H2O2,据此解答。
A.HO2-和H+分别穿过AEM、CEM在多孔固体电解质内结合生成H2O2,则CEM为阳离子交换膜,A正确;
B.该方法制取H2O2无污染物产生,为绿色方法,B正确;
C.电极b为阴极,O2在阴极得电子变为HO2-,结合得失电子守恒、电荷守恒、原子守恒可得电极反应式为:O2+2e-+H2O=HO2-+OH-,C错误;
D.未反应的去离子水溶解H2O2后流出,故通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度,D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
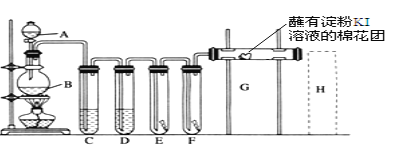
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式___________。
(2)D中放入浓H2SO4,其目的是________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是________,对比E和F中现象的差异可得出的结论及解释____________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______,反应的离子方程式是______________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成______。
(5)画出H处尾气吸收装置图并注明试剂________。
(6)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯浄Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
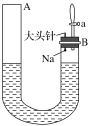
(1)钠与水反应的化学方程式为_____________。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________。
②能证明钠的熔点低的现象是_________。
③能证明有氢氧化钠生成的现象是__________。
④能证明有气体产生的现象是A端液面________(填“上升”“下降”或“不变”,下同),B端液面________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=____。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____K2(填“>”、“<”或“=”)。
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH=+67.2kJ·mol-1
2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1
2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____(填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.1L0.1molL-1NaNO2溶液中NO2-的数目为0.1NA
B.3.1g乙二醇中含有羟基的数目为NA
C.5.85gNa37Cl中所含质子总数为2.8NA
D.2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①标准状况下,含NA个氩原子的氩气体积约为22.4 L
②在Fe参与的反应中,1mol Fe失去的电子数为3NA
③标准状况下,11.2L Cl2溶于水转移的电子总数为0.5NA
④1L.1 mol/L 的Fe(OH)3胶体中含有NA个Fe(OH)3胶粒
⑤常温常压下,21g氧气和27g臭氧中含有的氧原子总数为3NA
⑥物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
A.①⑤B.①③⑥C.②③⑤D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要22.4L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是_______(填分子式)。产生这种结果的主要原因是_______________________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂_______,反应的离子方程式:______________。
②装置D加入的试剂及作用_______,装置F加入的试剂试剂及作用_______。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是______________。④U形管G的作用为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是( )
A.盐酸与碳酸钙反应:CO32-+2H+=CO2↑+H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3- =CaCO3↓+H2O
C.氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.Ba(OH)2与稀H2SO4反应的离子方程式:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
A.3mol C+1mol DB.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol CD.4molA+2mol B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com