
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
分析 ①晶体中含有受热不分解的杂质,会导致加热前后固体质量减少偏少;
②晶体尚带蓝色,即停止加热,会导致加热前后固体质量减少偏少;
③加热过程中,晶体有部分爆溅飞出坩埚,会导致加热前后固体质量减少偏多.
解答 解:①晶体中含有受热不分解的杂质,会导致加热前后固体质量减少偏少,固体减少的质量以结晶水计算,导致结晶水的量偏少,所以测定的n值偏低,故正确;
②晶体尚带蓝色,即停止加热,会导致加热前后固体质量减少偏少,固体减少的质量以结晶水计算,导致结晶水的量偏少,所以测定的n值偏低,故正确;
③加热过程中,晶体有部分爆溅飞出坩埚,会导致加热前后固体质量减少偏多,固体减少的质量以结晶水计算,导致结晶水的量偏多,所以测定的n值偏高,故错误;
故选A.
点评 本题以结晶水测定为载体考查化学实验方案评价,为高频考点,明确实验原理是解本题关键,知道反应前后固体质量减少量与结晶水的关系,注意③中如果有药品溅出,必须重做实验.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
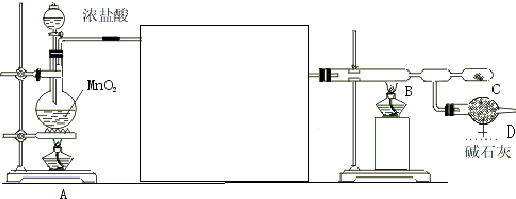
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
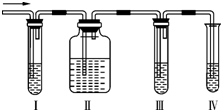 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
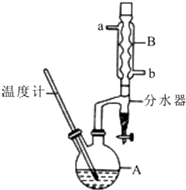 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不容 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com