
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NH3极易溶于水,可用于工业制冷剂
B.HNO3具有酸性,可用于制备硝酸盐原料
C.NH4 NO3易溶于水,可用于制造高温材料
D.N2难溶于水,可用于合成氨原料
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如![]() 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
紫铜 | 青铜 | 铜绿 | |
主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3 ];
除上述猜想外,其他合理的猜想是____________________(只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3 ]。于是按图5所示装置进行实验。
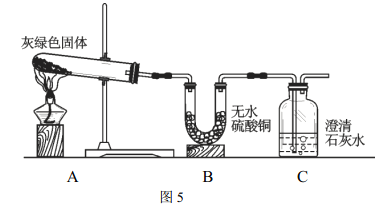
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________的现象, C中观察到了_____________的现象。B中所发生反应的化学方程式为:__________________。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品。
I. (1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) +CO2(g)===2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应的还原产物为 ,每生成1 mol Fe3O4,转移电子的物质的量为________mol;
②已知:C(s) +2H2O(g)===CO2(g)+2H2(g) ΔH=+113.4 kJ·mol-1,则反应:
3FeO(s) +H2O(g)===Fe3O4(s)+H2(g)的 ΔH=________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
Ⅱ. SO2直接排放会对环境造成危害。SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③能说明上述反应达到平衡状态的是 。
a. SO2 的消耗速率与CO2 的生成速率相同 b. 混合气体的密度不变
c. S2的浓度不变 d. SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.c(Na+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
d.水电离出c(H+)=1×10-8 mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的电极反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.钠、镁、铝原子半径依次增大
B.NH3H2O HF 稳定性依次减弱
C.H3PO4H2SO4HClO4酸性依次增强
D.NaOH Mg(OH)2 Al(OH)3碱性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
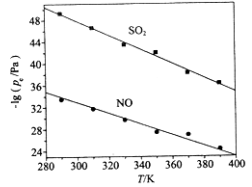
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:

请参照元素①一⑨在周期表表中的位置,用化学用语回答下列问题:
(1)写出元素⑥在周期表中的位置是____________。
(2)元素⑤、⑧、⑨的离子半径由大到小的顺序为______________。
(3)元素①④⑨形成原子个数比1:1:1化合物的电子式为_________;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:_________________。
(4)元素⑤和⑥最高价氧化物水化物反应的离子方程式为_______________。
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应的化学方程式为______________________,若反应中有6.02×1023个电子发生转移,则生成的气体标准状况下的体积为______L。
(6)写出一个方程式,证明元素⑧的非金属性比元素⑨弱:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
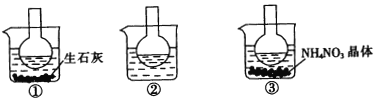
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是___________.
A.水解反应为放热 反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向三份0.01 mol L—1的CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体,则CH3COO-的水解平衡分别________、_________、_________。(填向“左移动”“向右移动”或“不移动”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com