
| A、5:2 | B、2:5 |
| C、1:1 | D、2:1 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
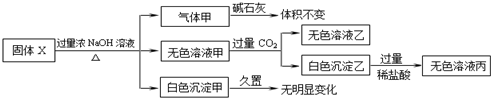
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中一定含有Na2O、Na2O2、和NaHCO3 |
| B、混合物中一定不含Na2CO3和NaCl |
| C、混合物中可能含有Na2O和NaCl |
| D、混合物中一定不含Na2O2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
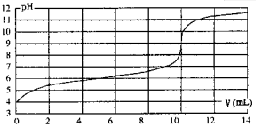
| A、HA的浓度为1×10-4mol?L-1 |
| B、实验时可选甲基橙作指示剂 |
| C、V=10mL,酸碱恰好中和 |
| D、pH=7时,溶液中c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com