


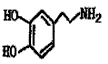
科目:高中化学 来源: 题型:阅读理解
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)芳香族化合物在生产生活中有广泛的用途。
Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分:
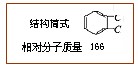
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2 与9g H2O。
(1)通过计算可知该有机物的分子式为: 。
(2)进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g 该物质与足量NaOH反应,消耗0.1mol NaOH。请写出一种符合该物质结构的结构简式:
Ⅱ。滴露是一种常用消毒剂。它的主要成分结构如下图:
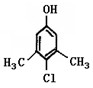
(1)它具有的官能团的名称:
(2)该分子在核磁共振氢谱图中显示出 种峰,其峰面积比为
(3)写出它与氢氧化钠溶液反应的化学方程式
Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如下图:
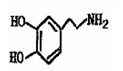
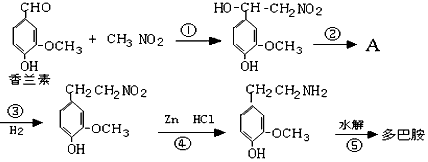
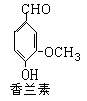
(1)多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得。合成过程示如下:

写出上述过程中①的反应类型:
写出②、⑤两步的化学方程式:
②:
⑤:
(2)写出香兰素的银镜反应的化学方程式
(3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应; ③显弱酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com