
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
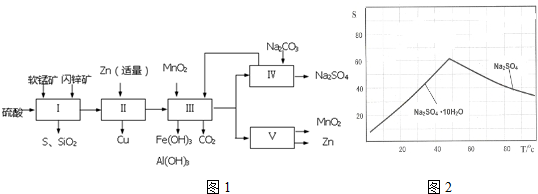
分析 依据流程图分析可知,流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫,及滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,流程Ⅲ中,加入MnO2将亚铁离子氧化成铁离子同时消耗酸而得到氢氧化铁和氢氧化铝沉淀,滤液中含有硫酸锰和硫酸锌,流程Ⅳ为滤液中加入碳酸钠得碳酸锰、碳酸锌可循环利用,滤液为硫酸钠溶液,流程Ⅴ为电解硫酸锰和硫酸锌混合溶液可得二氧化锰和锌,据此答题;
(6)①根据硫酸和氢氧化钠之间的中和反应来确定剩余的硫酸的物质的量;
②根据电子守恒和化合价变化之间的关系来计算.
解答 解:(1)流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫,及滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,其中FeS、CuS中硫元素及铁元素化合价都升高,所以被氧化的物质为,
故答案为:FeS、CuS;
(2)流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,反应的离子方程式为Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+,
故答案为:Zn+Fe3+=Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+;
(3)图表数据可知,亚铁离子沉淀完全的pH为7.6,而铁离子沉淀完全的pH为1.5,所以要将亚铁离子氧化成铁离子,使铁元素能全部沉淀,
故答案为:使铁元素能全部沉淀;
(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:乙醇洗涤;防止形成 Na2SO4•10H2O;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)①硫酸和氢氧化钠之间中和的实质是:H++OH-=H2O,用0.25mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70mL,这些氢氧化钠中和掉的硫酸的物质的量0.25mol/L×0.0217L×$\frac{1}{2}$=0.0027mol,剩余硫酸的物质的量0.0027mol×$\frac{1000}{15}$≈0.18mol,
故答案为:0.18;
②取1.95g锌加入到12.00mL18.4mol/L的浓硫酸中(反应中只生成一种还原产物),消耗的硫酸的物质的量是0.012L×18.4mol/L-0.18mol=0.0408mol.设硫酸的还原产物中,硫元素的化合价是n,金属锌的物质的量是:$\frac{1.95g}{65g/mol}$=0.03mol,生成硫酸锌的物质的量是0.03mol,所以0.03mol的硫酸显示酸性,根据电子守恒:$\frac{1.95g}{65g/mol}$×(2-0)=(0.0408mol-0.03mol)×(6-n),解得n=0,所以浓硫酸被还原的产物是硫单质,
故答案为:S.
点评 本题考查了物质制备实验的分析判断、物质溶解性的理解应用、电解原理的应用、实验基本操作、化学计算等,题目难度较大,答题时注意元素守恒、极限反应的灵活应用.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
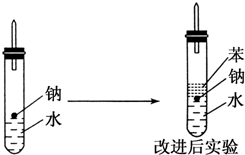 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
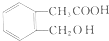
 ④
④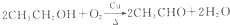 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| J | ||||
| R |
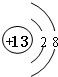 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能源的优点是来源广泛、无污染、便于运输与贮存 | |
| B. | 自然界中利用太阳能最成功的是植物的光合作用 | |
| C. | 植物秸秆、动物粪便、枯枝败叶中蕴藏着丰富的生物质能 | |
| D. | 利用太阳能、风能和氢能替代化石能源能改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com