
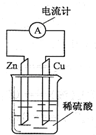
 如图所示的原电池装置,下列说法不正确的是( )
如图所示的原电池装置,下列说法不正确的是( )

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
(2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
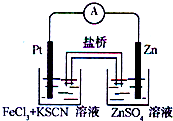 实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com