
| A. | O、Cl、S、P | B. | K+、Mg2+、Al3+、H+ | ||
| C. | Ca2+、Mg2+、Al3+、K+ | D. | I-、Br-、Cl-、F- |
分析 A.非金属性越强,原子氧化性越强,同周期自左而右原子半径减小、电子层越多原子半径越大;
B.金属性越强,阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.金属性越强,阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.非金属性越强,阴离子还原性越弱,电子层越多离子半径越大.
解答 解:A.非金属性Cl>S>P,故氧化性Cl>S>P,O>S>P,同周期自左而右原子半径减小、电子层越多原子半径越大,故原子半径P>S>Cl>O,故A错误;
B.金属性越强,阳离子氧化性越弱,故氧化性K+<Mg2+<Al3+<H+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径K+>Mg2+>Al3+>H+,故B正确;
C.金属性越强,阳离子氧化性越弱,故氧化性K+<Ca2+<Mg2+<Al3+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Ca2+>Mg2+>Al3+,故C错误;
D.非金属性越强,阴离子还原性越弱,故还原性:I->Br->Cl->F-,电子层越多离子半径越大,故离子半径:I->Br->Cl->F-,故D错误,
故选B.
点评 本题考查微粒半径比较、离子氧化性及还原性比较,难度不大,掌握比较规律即可解答,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 分子式为C3H7C1的有机物有三种同分异构体 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 试剂B | 湿润的试纸A | 结论 |
| A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
| B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
| C | Na2SO3、硫酸 | 品红试纸褪色 | SO2具有漂白性 |
| D | Cu、浓硝酸 | 淀粉KI试纸变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
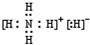 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com