
| 10.8g |
| 18g/mol |
| 39.6g |
| 44g/mol |
 ,
, .
.


科目:高中化学 来源: 题型:
| A、用托盘天平称取NaCl固体23.4g |
| B、应选用500mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2cm时改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在一密闭体系中发生下列反应A(g)+3B(g)?2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
在一密闭体系中发生下列反应A(g)+3B(g)?2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
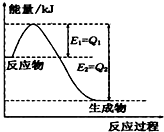 (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:
(1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com