
分析 ①H2CO3是弱酸部分电离;
②Na2CO3是强碱弱酸盐,水解时碳酸根离子与水电离出的氢离子结合;
③NaHCO3是强碱弱酸盐的酸式盐,水解时碳酸氢根离子与水电离出的氢离子结合;
④NH4HCO3溶液中是弱酸弱碱的酸式盐,发生相互促进的水解;
⑤(NH4)2CO3是弱酸弱碱盐,发生相互促进的水解;据此即可解答.
解答 解:物质的量浓度相同的Na2CO3、NaHCO3、H2CO3、(NH4)2CO3、NH4HCO3溶液中,根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,令其物质的量浓度为0.1mol/L,则:
①H2CO3溶液是二元弱酸,且酸性很弱,电离时分两步电离,电离出的碳酸根离子浓度较小,但它是酸,溶液显酸性,所以,碳酸根浓度小于0.1mol/L,NH4HCO3溶液中电离出碳酸根离子只需碳酸氢根离子一步电离,而H2CO3溶液是二元弱酸,需两步电离,且第二步极其微弱,其碳酸根离子的浓度比NH4HCO3溶液中碳酸根离子浓度小;
②Na2CO3是易溶于水的盐,在水中完全电离,电离出的碳酸根离子部分水解,但水解微弱,所以,碳酸根离子浓度降低,碳酸根浓度接近0.1mol/L;
③NaHCO3是易溶于水的盐,在水中完全电离,电离出的碳酸氢根离子水解建立水解平衡,因碳酸氢钠溶液显碱性,所以,部分碳酸氢根离子的电离小于其水解,所以碳酸根浓度远远小于碳酸氢根浓度,及远远小于0.1mol/L;
④NH4HCO3是易溶于水的盐,在水中完全电离在水中完全电离,电离出的铵根离子和碳酸氢根离子分别和水电离出的氢氧根离子和氢离子结合,水解相互促进,所以,碳酸氢根离子电离出来的碳酸根离子的浓度非常小,比NaHCO3溶液中碳酸根离子浓度小;
⑤(NH4)2CO3是易溶于水的盐,在水中完全电离,电离出的铵根离子和碳酸根离子分别和水电离出的氢氧根离子和氢离子结合,水解相互促进,所以,碳酸根离子浓度比Na2CO3中碳酸根离子离子浓度小一些,碳酸根离子略小于0.1mol/L;
综上碳酸根离子浓度为:②Na2CO3>⑤(NH4)2CO3>③NaHCO3>④NH4HCO3>①H2CO3;
故答案为:②Na2CO3>⑤(NH4)2CO3>③NaHCO3>④NH4HCO3>①H2CO3.
点评 本题主要考查了盐类水解的应用,解答须掌握盐类水解的规律影响因素及应用,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
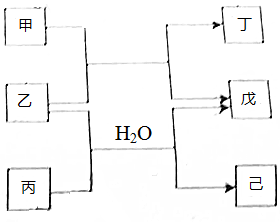 短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )
短周期元素E,R,X,Y,Z的原子序数依次增大,它们组成的单质或化合物存在如图转化关系,甲、丁为二元化合物,乙戊为单质,丙和已为三元化合物.25℃时,0.1 mol•L-1甲溶液的pH=1,0.1mol•L-1丙溶液的pH=13.丁、己溶液混合时产生白色沉淀,下列推断不正确的是( )| A. | 简单离子半径:r(Z)>r(R)>r(X)>r(Y) | |
| B. | X,Y,Z的最高价氧化物对应的水化物相互反应 | |
| C. | R,E,Z可存在于同一种共价化合物中 | |
| D. | Z的阴离子夺质子能力较R的阴离子强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHCO3溶液中c(Na+)>c(HCO3-)+2c(H2CO3) | |
| B. | 25℃时,pH=4.75、浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 室温下,向0.1mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 10mL0.1mol•L-1 CH3COOH溶液加入一定质量的量的NaOH后,溶液中离子的浓度由大到小的顺序可能是:c(Na+)>c(CH3COO-)+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40g | B. | 4.0g | C. | 4.0×10-11g | D. | 4.0×10-12g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
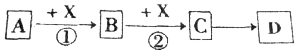
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与盐酸反应:OH-+H+=H2O | |
| B. | 氯气通入HI溶液中:Cl2+I-=Cl-+I2 | |
| C. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| D. | 稀H2SO4与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用过量的乙醇能使乙酸完全转化为乙酸乙脂 | |
| B. | 酯化反应时,生成的酯基个数与水分子个数相同 | |
| C. | 用过滤的方法分离乙酸乙酯和碳酸钠饱和溶液的混合物 | |
| D. | CH3CH(OH)COOH不能相互反应生成聚脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 该反应可表示为: = = + +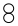 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:
秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com