
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
分析 (1)①根据CO的转化率计算参加反应CO的物质的量,根据方程式计算生成甲醇的物质的量,再根据v=$\frac{△c}{△t}$计算v(CH3OH);
由方程式可知3mol气体反应生成1mol气体,故该反应为熵减的反应,根据△G=△H-T△S<0,可以自发进行,据此判断;
②A.缩小容器的体积,压强增大,平衡向右移动,但c(CO)将变大;
B.浓度降低,反应速率减小;
C.恒温、恒容条件下,随反应进行,容器内压强减小,容器内的压强不发生变化,反应达到平衡状态;
D.CH3OH生成速率与CO消耗速率,均表示正反应速率;
E.使用合适的催化剂,加快反应速率,不影响平衡移动;
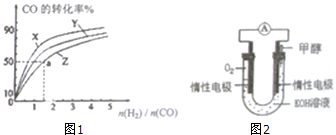
(2)①由图可知,H2和CO的起始组成比一定时,平衡时CO转化率:X>Y>Z,升高温度平衡向吸热反应方向移动,结合反应热效应判断温度关系;
②根据CO的转化率计算参加反应的CO物质的量,利用三段式计算平衡时各组分物质的量,由于容器体积为1L,用物质的量代替浓度代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
(3)根据盖斯定律,已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;
电解过程中,开始阴极是Cu2+放电生成Cu,没有气体生成,阳极是Cl-放电生成Cl2,电解一段时间后,标况下当两极收集到相同体积的气体,说明阳极上氢离子放电生成H2,由于氢离子、氯离子浓度相等,则二者物质的量相等,等量的氢离子、氯离子放电生成氢气、氯气体积相等,根据电子转移守恒,氯离子放电完毕时,氢离子有剩余,二者最终两极生成氢气体积相等,故阳极上氯离子放电完毕,且氢氧根离子放电,根据根据电子转移守恒计算生成氧气物质的量,再根据V=nVm计算其体积.
解答 解:(1)①10分钟时反应达平衡,CO的转化率为50%,则参加反应CO的物质的量为1mol×50%=0.5mol,由CO(g)+2H2(g)?CH3OH(g),可知生成甲醇的物质的量为0.5mol,容器体积为1L,则v(CH3OH)=$\frac{\frac{0.5mol}{1L}}{10min}$=0.05mol/(L.min);
由方程式可知3mol气体反应生成1mol气体,故该反应为熵减的反应,该反应在低温下能自发进行,根据△G=△H-T△S<0,反应自发进行,则反应的△H<0,
故答案为:0.05mol/(L.min);<;
②A.缩小容器的体积,压强增大,平衡向右移动,平衡时生成物的浓度增大,而平衡常数不变,故平衡时反应物的浓度也增大,故平衡时c(CO)将变大,故A正确;
B.平衡时移走部分甲醇,瞬间正反应速率不变,逆反应速率减小,平衡向正反应方向移动,而后反应速率减小,故B错误;
C.恒温、恒容条件下,随反应进行,容器内压强减小,容器内的压强不发生变化,反应达到平衡状态,故C正确;
D.CH3OH生成速率与CO消耗速率,均表示正反应速率,二者反应速率始终相等,故D错误;
E.使用合适的催化剂,加快反应速率,缩短达到平衡的时间,不影响平衡移动,CO的转化率不变,故E错误,
故选:BDE;
(2)①由图可知,H2和CO的起始组成比一定时,平衡时CO转化率:X>Y>Z,由(1)可知该反应正反应为放热反应,升高温度平衡向逆反应方向移动,CO的转化率减小,故温度:X<Y<Z,即Z曲线对于的温度为270℃,
故答案为:270℃;
②$\frac{n({H}_{2})}{n(CO)}$=1.5,CO起始物质的量为1mol,则氢气起始物质的量为1.5mol,反应达平衡,CO的转化率为50%,则参加反应CO的物质的量为1mol×50%=0.5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):1 1.5 0
变化(mol)0.5 1 0.5
平衡(mol):0.5 0.5 0.5
由于容器体积为1L,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4,
故答案为:4;
(3)已知:①CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-1
②H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
根据盖斯定律,①-②可得:CH3OH(g)+H2O(g)?CO2(g)+3H2(g),则焓变△H3=△H1-△H2=(-192.9kJ.mol-1)-(-120.9kJ.mol-1)=-70kJ.mol-1,
故答案为:-70kJ.mol-1;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
电解过程中,开始阴极是Cu2+放电生成Cu,没有气体生成,阳极是Cl-放电生成Cl2,电解一段时间后,标况下当两极收集到相同体积的气体,说明阳极上氢离子放电生成H2,由于氢离子、氯离子浓度相等,则二者物质的量相等,等量的氢离子、氯离子放电生成氢气、氯气体积相等,根据电子转移守恒,氯离子放电完毕时,氢离子有剩余,二者最终两极生成氢气体积相等,故阳极上氯离子放电完毕,且氢氧根离子放电,
溶液中含有n(Cu2+)=0.5mol/L×0.2L=0.1mol,n(Cl-)=2mol/L×0.2L=0.4mol,根据氯原子守恒可知生成氯气为0.2mol,
设生成氧气为x mol,则生成氢气为(x+0.2)mol,根据电子转移守恒:
0.1mol×2+(x+0.2)mol×2=0.2mol×2+x mol×4
解得x=0.1,
故生成氧气的质量为0.1mol×32g/mol=3.2g,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;3.2g.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡影响因素、电极反应式书写、电解有关计算,(4)中关键是判断发生的反应,注意利用电子转移守恒解答,难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 -
-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
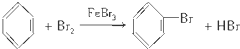
 ;反应类型:取代反应
;反应类型:取代反应 ;反应类型:加聚反应
;反应类型:加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子最外层电子排布呈周期性变化 | |
| C. | 元素原子量依次递增 | |
| D. | 元素的最高正化合价呈周期性变化同温同压下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com