
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 根据分子式可知是烷烃,四个甲基就是除主链外还有2个支链,支链可以是甲基,也可以是乙基,根据位置异构确定同分异构体来解答.
解答 解:分子式为C8H18是烷烃,四个甲基就是除主链外还有2个支链,支链可以是甲基,也可以是乙基,甚至是丙基,先考虑主链由长到短,六个碳的己烷开始有6种:2,2-二甲基己烷,2,3-二甲基己烷,2,4-二甲基己烷,2,5-二甲基己烷,3,3-二甲基己烷,3,4-二甲基己烷;再缩短到5个碳的主链有2种:2-甲基-3-乙基戊烷,3-甲基-3-乙基戊烷,而1个丙基结构不满足题目4个甲基的要求,所以共有8种,
故选:D.
点评 本题考查限制条件同分异构体的书写,难度中等,注意取代基的变化.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
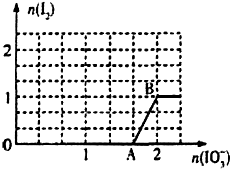 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
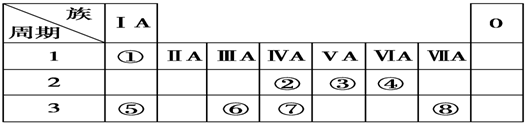
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | A | B | C | D |
| 物 质 | CaCl2 | H2O2 | H2SO4 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L层电子数为奇数的所有元素都是非金属 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 元素周期表中第8、9、12列没有非金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com