
(4分)工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。试配平该反应的化学方程式,并标出电子转移的总数及方向。
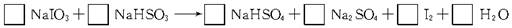
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:物理教研室 题型:038
5NaHSO3 + 2KIO3 + H2SO4 = 5NaHSO4 + K2SO4 + I2 + H2O
(1)该反应中何者为氧化剂、还原剂?
(2)若欲生产2.54kg碘理论上需用去多少千克的亚硫酸氢钠?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)第二步反应的离子方程式是_________________。
(2)上述两步反应中共用去的NaIO3和NaHSO3的物质的量的最简整数比是______________。
(3)工业上获得1mol碘,需_________________mol NaHSO3。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
![]()
(1)该反应中何者为氧化剂、还原剂?
(2)若欲生产2.54kg碘理论上需用去多少千克的亚硫酸氢钠?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省鹤壁高中高一第二次月考化学试卷(带解析) 题型:填空题
(4分)工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。试配平该反应的化学方程式,并标出电子转移的总数及方向。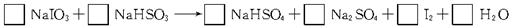
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com