
【题目】主族元素在周期表中的位置取决于( )
A.元素原子核内的中子数
B.元素的最高正化合价
C.元素原子的电子层数
D.元素原子核外的电子层数和最外层上的电子数
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种综合性能优良的陶瓷材料,能缓慢水解,不耐酸碱腐蚀。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。请回答:
Ⅰ.制备AlN
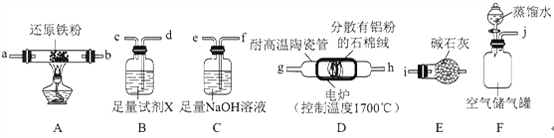
(1)实验时,以空气为原料制备AlN。按气流由左向右的方向,上述装置的正确连接顺序为j→________→i(填仪器接口字母编号)。
(2)上述装置中,需要检漏的仪器名称为________。
(3)试剂X的作用为________。
(4)装置D中发生反应的化学方程式为________。
Ⅱ.测定产品纯度
(5)设计实验证明:装置D的产品中含有Al单质________。
(6)测定产品纯度:取装置D中产品4.37g,加入足量NaOH浓溶液;通入水蒸气,将生成的气体全部蒸出,用V1mLc1mol·L-1的盐酸吸收;以酚酞作指示剂,用c2mol·L-1的NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗V2mLNaOH标准溶液。则:
①达到滴定终点的现象为________。
②产品中A1N的质量分数为________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2,2-二甲基丙烷也称为新戊烷 B. 由苯制取溴苯的反应属于加成反应
C. C3H6Br2有5种结构 D. 乙醇和乙酸均为非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图所示。
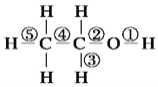
(1)乙醇与金属钠反应时化学键断裂的位置是_______(填序号)。
(2)乙醇催化氧化为乙醛时化学键断裂的位置是_______(填序号)。
(3)1 mol乙醇和足量钠反应,生成_______mol H2
<span style="font-size: 14px; font-family: "宋体";"><span contenteditable="true">(4)</span></span>写出下列反应的化学方程式
①乙醇和金属钠反应___________________________________。
②乙醇的催化氧化反应___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素。下列说法正确的是( )
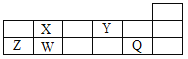
A. W、X两元素在自然界中都存在相应的单质
B. Q、Y分别与钠元素形成的化合物中仅含离子键
C. 简单离子半径由大到小的顺序为:Q>Y>Z
D. X、Z的最高价氧化物对应的水化物之间易发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下将0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)__________0.2 mol/LHCl溶液中由水电离出的c(H+)。(填“>”“<”或“=”),该混合溶液的物料守恒式为 。
(2)常温下若将0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
(4)纯碱溶液呈碱性的原因(用离子方程式表示)__________________________,纯碱溶液离子浓度由大到小的顺序为 。
(5)某温度时,测得0.01 mol/L的NaOH溶液pH为11,在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com