
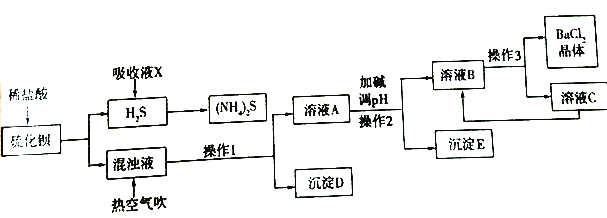
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3的过程是将容液B蒸发浓缩、________、过滤等。
(4)沉淀D的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
【答案】 ![]() BaS+2HCl=BaCl2+H2S↑ NH3H2O 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ 过滤 降温结晶 S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+ BaCl2
BaS+2HCl=BaCl2+H2S↑ NH3H2O 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ 过滤 降温结晶 S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+ BaCl2
【解析】氯化钡为离子化合物,化学式BaCl2,氯化钡的电子式为 ![]() ;根据强酸制备弱酸规律:盐酸和硫化钡反应生成氯化钡和硫化氢气体,化学方程式为BaS+2HCl=BaCl2+H2S↑;正确答案:
;根据强酸制备弱酸规律:盐酸和硫化钡反应生成氯化钡和硫化氢气体,化学方程式为BaS+2HCl=BaCl2+H2S↑;正确答案:![]() ; BaS+2HCl=BaCl2+H2S↑。
; BaS+2HCl=BaCl2+H2S↑。
(2)根据流程看出,通入吸收液X后产生了硫化铵,所以吸收液X的溶质是.NH3H2O;一定条件下向(NH4)2S溶液中通入空气,可得到单质硫和一水合氨,反应的化学方程式为. 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓;正确答案:NH3H2O;2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓。
(3)根据流程可知,浊液通入热空气产生沉淀,所以操作1的名称是过滤;从氯化钡溶液中得到氯化钡晶体,可以采用将溶液B进行蒸发浓缩、降温结晶、过滤等操作;正确答案:过滤;降温结晶。
(4)由于 BaS+2HCl=BaCl2+H2S↑反应,会有少量硫化氢溶在氯化钡溶液中,通入热空气,会把硫化氢氧化为硫单质,所以沉淀D的成分是S(或硫);正确答案: S(或硫)。
(5)热空气吹除时会有部分HS-转变为S2O32-,S2O32-与氢离子发生氧化还原反应,生成单质硫和二氧化硫气体,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O;正确答案:S2O32-+2H+=S↓+SO2↑+H2O。
(6) 室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38;镁离子完全沉淀,溶液中c(OH-)2= Ksp[Mg(OH)2]/c(Mg2+)=1.8×10-11/1×10-5=1.8×10-6,c(OH-)=1.34×10-3,c(H+)=7.5×10-12,结果pH大于9;铁离子沉淀完全,溶液中c(OH-)3=Ksp[Fe(OH)3]/ c(Fe3+)= 4.0×10-38/1×10-5=4×10-33, c(OH-)=1.45×10-11, pH c(H+)=6.9×10-3, 结果pH小于9,铁离子沉淀完全;综上分析,室温时,若加碱调溶液pH至9时,完全沉淀的离子是Fe3+;正确答案:Fe3+。
(7)从流程看出,氯化钡结晶后,会有少量残留在溶液C中,通过循环利用,提高了氯化钡的利用率;正确答案:BaCl2。


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下图是生物体细胞内部分有机化合物的概念图,请回答问题:

(1)小麦种子中的储能物质c是_________。
(2)氨基酸的结构通式为_____________。b结构的多样性取决于氨基酸的种类、数目、排列顺序以及________________。
(3)在小麦叶肉细胞中,e主要存在于________中,可用________将其染成______色。
(4)人体细胞所含d中________________参与血液中脂质的运输,若d是人体细胞膜的主要成分,则d 是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4P+3KOH+3H2O===3KH2PO2+PH3,已知PH3的P的化合价为-3,磷单质在反应中
A.被氧化B.被还原
C.既被氧化又被还原D.既未被氧化又未被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需配制 0.1mol/LNaOH 溶液 500mL,右图是某同学转移溶液的示意图。
(1)图中的错误是__________________。除了图中给出的的仪器和托盘天平外,还需要的仪器有:_____________.
(2)根据计算得知,所需NaOH的质量为_______________.
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________________________.

A.用 30mL 水洗涤烧杯 2~3 次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约 30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入 500mL 的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度 1~2cm 处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有洗涤烧杯 _________________ 若加蒸馏水时不慎超过了刻度线________________________ 若定容时俯视刻度线 ________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中,能大量共存的离子组是( )
A.Cu2+、Na+、SO42﹣、Cl﹣
B.Ba2+、Na+、OH﹣、SO42﹣
C.OH﹣、HCO3﹣、Ca2+、Na+
D.K+、Na+、OH﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中ΔH小于零的是( )
A. Ba(OH)2与NH4Cl固体混合反应 B. 氯化铵分解得氨气
C. 碳酸钙分解得二氧化碳 D. 验室制备氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com