
解释下列操作或事实的离子方程式正确的是
A.把钠投入水中:2Na+2H2O 2Na+ + 2OH- +O2↑
2Na+ + 2OH- +O2↑
B.把铜片放入氯化铁溶液中:Cu +Fe3+ Cu2+ +Fe2+
Cu2+ +Fe2+
C.铝制容器不能长期存放碱性食物:2Al + 2OH-  2AlO2- + H2↑
2AlO2- + H2↑
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2 I2+2H2O
I2+2H2O
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:计算题
(2分)若25℃时,CH3 COOH的电离平衡常数Ka = 1.8×10-5,则该温度下0.18mol/L的CH3 COONa溶液的pH= (CH3 COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3 COONa溶液的浓度)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
下列实验现象描述正确的是
A.电解氯化铜溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
D.向含有苯酚的苯溶液中滴入少量浓溴水,产生了白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:实验题
(12分)某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件。某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10 mol/L硝酸反应时有NO2气体生成,可能还有NO生成。
查阅资料:常温下,NO2与N2O4混合存在,在低于0 ℃时几乎只有无色的N2O4液体或晶体存在。
设计如下装置进行实验。按下图连接装置并检验气密性后,称取5 g 合金放于圆底烧瓶中,并滴加10 mol/L硝酸。
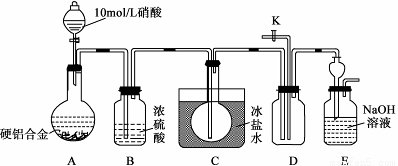
①合金中Cu与稀硝酸反应的离子方程式是 。
②C装置的目的是 。
③能证明有NO2生成的实验现象是 ,能证明有NO生成的实验操作与现象是 。
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10 mol/L硝酸反应时没有NO生成。乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是 。
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
Al3+ | 3.4 | 4.7 |
Cu2+ | 4.1 | 6.9 |
Mg2+ | 9.4 | 12.4 |
pH > 7.8时,Al(OH)3开始溶解,pH > 10.8时沉淀完全溶解。
设计如下方案并进行实验:
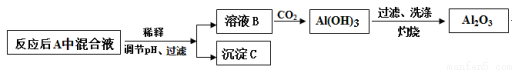
①调节pH时,应控制pH的范围是 。
②选用NaOH溶液调节pH,得到溶液B的离子方程式是 。
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
ClO2是一种高效安全的杀菌消毒剂,还可用于除去水中的CN –离子,转化为2种无毒气体。下列判断正确的是
A.ClO 2是还原剂
B.1 mol ClO 2转移3mol电子
C.CN –离子转化为NO2和CO2
D.氧化剂与还原剂的物质的量之比是1∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
某温度时,向2.0 L恒容密闭容器中充入0.5 mol PCl5,发生反应
PCl5(g) 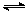 PCl3(g) + Cl2(g),经过一段时间后达到平衡。反应过程中测得部分数据如下,下列说法正确的是
PCl3(g) + Cl2(g),经过一段时间后达到平衡。反应过程中测得部分数据如下,下列说法正确的是
t/s | 0 | 50 | 100 | 250 | 350 |
n(PCl5) | 0. 5 | 0.42 | 0.41 | 0.40 | 0.40 |
A.100 s时,c(PCl3)= 0.09 mol·L-1
B.保持其他条件不变,降低温度,平衡时c(PCl3)=0.045 mol·L-1,则该反应的ΔH <0
C.相同温度下,起始时向上述容器中充入0.25 mol PCl3、0.25 mol Cl2,达平衡时,PCl3的转化率小于80%
D.相同温度下,起始时向上述容器中充入0.20 mol PCl5、0.20 mol PCl3、0.10 mol Cl2,此时反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:填空题
铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝离子的结构示意图为 。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)氢氧化铝是医用的胃酸中和剂的一种。用离子方程式表示其作用机理是 。
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对。 |
B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对。 |
C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对。 |
D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对。 |
(6)钢铁的析氢腐蚀简单示意图如下图所示,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图。
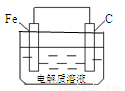
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
标准状况下,某同学向100 mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中正确的是

A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S===3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com