
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程,下列叙述中不正确的是( )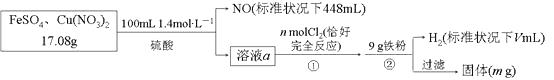
A.n=0.02
B.V=2240
C.m=3.2
D.元混合物中FeSO4的质量分数约为89%
【答案】C
【解析】解:步骤②中加入铁粉后有H2生成,说明前面所加硫酸过量,溶液a能与Cl2反应,说明含有Fe2+ , 即加稀硫酸反应后,Fe2+有剩余;则加入稀硫酸时发生的反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中NO3全部被还原为NO,根据元素守恒由n(NO)=0.02mol可得样品中m[Cu(NO3)2]=0.01 mol×188 g·mol1=1.88g,则 m(FeSO4)=17.08g1.88g=15.20g,其物质的量 n(FeSO4)=0.1 mol,原混合物中FeSO4的质量分数为 ![]() ×100%=89%,故 D 正确。反应 3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06mol,则溶液a中的 Fe2+为0.04mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化 0.04 mol Fe2+需要 0.02molCl2 , 即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O 中消耗的H+为0.08mol,则溶液a中的H+为0.14mol×20.08 mol=0.2mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1molFe3+ , 溶液 a 中还 0.01molCu2+;反应 2Fe3++Fe==3Fe2+消耗0.05molFe,反应Cu2++Fe==Cu+Fe2+消耗0.01 molFe,同时生成0.01molCu,反应Fe+2H+==Fe2++H2↑消耗 0.1 molFe,生成0.1molH2 , 标准状况下H2体积为2240mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56g·mol1=0.04g,则最后过滤所得固体质量 m=(0.64+0.04) g=0.68g,故C不正确。
×100%=89%,故 D 正确。反应 3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06mol,则溶液a中的 Fe2+为0.04mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化 0.04 mol Fe2+需要 0.02molCl2 , 即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O 中消耗的H+为0.08mol,则溶液a中的H+为0.14mol×20.08 mol=0.2mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1molFe3+ , 溶液 a 中还 0.01molCu2+;反应 2Fe3++Fe==3Fe2+消耗0.05molFe,反应Cu2++Fe==Cu+Fe2+消耗0.01 molFe,同时生成0.01molCu,反应Fe+2H+==Fe2++H2↑消耗 0.1 molFe,生成0.1molH2 , 标准状况下H2体积为2240mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56g·mol1=0.04g,则最后过滤所得固体质量 m=(0.64+0.04) g=0.68g,故C不正确。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】现有一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)知CO和H2O的起始浓度均为2mol/L经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应(填是或否)达到平衡状态,若未达到,向方向移动.
(2)达平衡状态时,CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 78g Na2O2固体中阴离子的个数为2NA
B. 标准状况下,1.12L氯气与H2O反应,反应中转移的电子数为0.1NA
C. 60g SiO2含有的化学键数目为4NA
D. CO2通过Na2O2使其增重ag时,反应中转移的电子数为aNA/56
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
A.x=1
B.2 min内A的反应速率为0.3 mol/(Lmin)
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,可能大量共存于无色溶液中的是 ( )
A. Na+、H+、CO32-、NO3- B. Fe3+、Mg2+、Cu2+、Cl-
C. Na+、OH-、HCO3-、Cl- D. Ba2+、Cl-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)=1xl0﹣13 mol/L的溶液中:K+、Na+、SiO ![]() 、SO
、SO ![]()
B.1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO ![]() 、Cl﹣
、Cl﹣
C.在c(OH﹣):c(H+)=1×1012的溶液:NH ![]() 、Ca2+、C1﹣、K+
、Ca2+、C1﹣、K+
D.甲基橙显黄色的溶液:Na+、CO ![]() 、NO
、NO ![]() 、SO
、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.40mL
B.45mL
C.50mL
D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com