
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:![]()
![]()
![]() 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
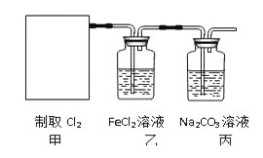
![]() 在该实验中,甲部分的装置是_______
在该实验中,甲部分的装置是_______![]() 填字母
填字母![]() 。
。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应的离子方程式是________________。
反应的离子方程式是________________。
![]() 已知酸性:
已知酸性:![]() ,丙装置中通入少量
,丙装置中通入少量![]() ,可制得具有漂白、消毒的物质,这种物质是_______
,可制得具有漂白、消毒的物质,这种物质是_______![]() 化学式
化学式![]() 。
。
![]() 有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“
有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“![]() ”中“最合适的化学试剂”反应的离子方程式_________________________。
”中“最合适的化学试剂”反应的离子方程式_________________________。
(3)家庭中常用消毒液![]() 主要成分
主要成分![]() 与洁厕灵
与洁厕灵![]() 主要成分盐酸
主要成分盐酸![]() 清洁卫生。某品牌消毒液包装上说明如下图。
清洁卫生。某品牌消毒液包装上说明如下图。

![]() “与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
![]() 漂粉精
漂粉精![]() 主要成分
主要成分![]() 与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O c
MnCl2+Cl2↑+2H2O c ![]()
![]()
![]() 增加尾气处理装置
增加尾气处理装置 ![]()
![]() Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO
Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)实验室用二氧化锰和浓盐酸在加热条件下制取氯气。
(2) ![]() 用反应
用反应![]()
![]()
![]() 制取氯气,应选择固体和液体在加热条件下反应的装置。
制取氯气,应选择固体和液体在加热条件下反应的装置。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应生成FeCl3。
反应生成FeCl3。
![]() 碳酸钠溶液中通入少量
碳酸钠溶液中通入少量![]() ,制得的具有漂白、消毒的物质是NaClO。
,制得的具有漂白、消毒的物质是NaClO。
![]() 氯气有毒,不经处理就排放会造成环境污染,该实验没有尾气处理装置,应该用NaOH溶液吸收过量的氯气。
氯气有毒,不经处理就排放会造成环境污染,该实验没有尾气处理装置,应该用NaOH溶液吸收过量的氯气。
(3) ![]() NaClO与盐酸反应会生成氯气,发生了氯气和水反应的逆反应。
NaClO与盐酸反应会生成氯气,发生了氯气和水反应的逆反应。
![]() 漂粉精的有效成分
漂粉精的有效成分![]() 能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。据此写出发生反应的化学方程式。
能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。据此写出发生反应的化学方程式。
![]() 浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气、水,反应化学方程式为 MnO2+4HCl(浓)
浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气、水,反应化学方程式为 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
![]() 甲中发生反应:
甲中发生反应:![]()
![]()
![]() ,根据该反应知,反应物是固液混合的,反应条件是加热,应选择装置c;
,根据该反应知,反应物是固液混合的,反应条件是加热,应选择装置c;
故答案为:c;
![]() 氯气具有强氧化性,与氯化亚铁反应生成氯化铁,反应离子方程式为:
氯气具有强氧化性,与氯化亚铁反应生成氯化铁,反应离子方程式为:![]()
![]() ;
;
故答案为:![]()
![]() ;
;
![]() 氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,由于酸性:
氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,由于酸性:![]() ,所以次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以化学方程式为:
,所以次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以化学方程式为:![]() ,具有漂白、消毒的物质是NaClO;
,具有漂白、消毒的物质是NaClO;
故答案为:NaClO;
![]() 氯气是有毒气体,所以不能直接排放到空气中,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,改进措施为增加尾气处理装置;氯气与氢氧化钠溶液反应的离子方程式为
氯气是有毒气体,所以不能直接排放到空气中,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,改进措施为增加尾气处理装置;氯气与氢氧化钠溶液反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 次氯酸根离子与氯离子在酸性条件下发生氧化还原反应生成氯气和水,离子方程式为:
次氯酸根离子与氯离子在酸性条件下发生氧化还原反应生成氯气和水,离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 漂粉精的有效成分
漂粉精的有效成分![]() 能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO
能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO![]() 2HCl+O2↑。
2HCl+O2↑。


科目:高中化学 来源: 题型:
【题目】(1)比较结合H+能力的相对强弱:H2O_____NH3(填“>”、“<”或“=”);用一个离子方程式说明H3O+和NH4+给出H+能力的相对强弱_____。
(2)NaCN是离子化合物,各原子均满足8电子稳定结构。写出NaCN的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为120g·mol-1,从结构上分析其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
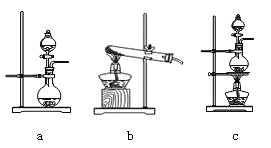
【题目】实验室中某些气体的制取、干燥及收集装置如图所示(省略夹持装置和尾气处理装置),仅用此装置和表中提供的物质完成相关实验,合理的是( )
选项 | a中物质 | b中物质 | c中干燥剂 | d收集气体 |
|
A | 浓硫酸 | 亚硫酸钠 | 无水氯化钙 | SO2 | |
B | 稀硫酸 | 大理石 | 无水氯化钙 | CO2 | |
C | 稀硝酸 | 铜片 | 碱石灰 | NO | |
D | 浓氨水 | 熟石灰 | 碱石灰 | NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:

已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计得最严密的是( )
A.检验试液中的![]() :试液
:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
C.检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D.检验试液中的![]() :试液
:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:
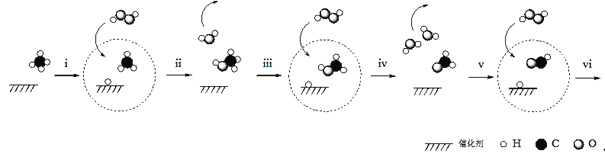
下列说法不正确的是( )
A.图中![]() 代表H2O2
代表H2O2
B.步骤i、ii的总反应方程式是![]()
C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
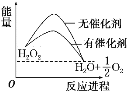
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com