
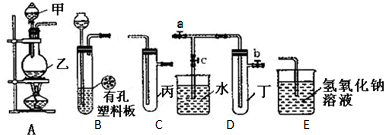
分析 (1)根据仪器的特征以及常见仪器的名称解答;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;氯气与水反应生成盐酸和次氯酸,盐酸可使紫色溶液变红,氯气能和强碱反应生成次氯酸盐、氯化物和水,次氯酸盐具有漂白性,能使石蕊溶液褪色;
(3)①浓硝酸具有强氧化性,与铜反应生成二氧化氮气体;
②根据二氧化氮溶于水形成压强差分析;
③先根据二氧化氮的体积计算硝酸的物质的量,进而计算浓度.
解答 解:(1)甲仪器具有球形特征,带有玻璃活塞,为分液漏斗,乙容器底部表面积比较大,为圆底烧瓶,
故答案为:分液漏斗、圆底烧瓶;
(2)实验室用二氧化锰与浓盐酸在加热条件下制取氯气,二氧化锰具有氧化性,氯化氢具有还原性,两者反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气与水反应生成盐酸和次氯酸,盐酸可使紫色溶液变红,氯气能和强碱反应生成次氯酸盐、氯化物和水,次氯酸盐具有漂白性,能使石蕊溶液褪色,原理为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;溶液红色褪去;Cl2+2OH-=Cl-+ClO-+H2O;
(3)①铜和浓硝酸反应生成硝酸铜、二氧化氮和水,方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②若二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管丁,所以先关闭止水夹 ab再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后水倒流,使烧杯中的水进入试管丁,
故答案为:ab;c;
③设容器的体积为VL,所以二氧化氮气体的物质的量为n=$\frac{VL}{22.4L/mol}$,二氧化氮和氧气、水反应生成硝酸,所以溶质是硝酸.
设生成硝酸的物质的量为xmol;
4NO2+O2+2H2O=4HNO3
4mol 4mol
$\frac{VL}{22.4L/mol}$ xmol
x=$\frac{VL}{22.4L/mol}$,
C=$\frac{n(HN{O}_{3})}{V}$=$\frac{VL}{\frac{22.4L/mol}{VL}}$≈0.045mol/L,
故答案为:0.045 mol•L-1.
点评 本题考查氯气的实验室制法及氯气、二氧化氮的性质,侧重于学生的分析能力、实验能力和计算能力的考查,注意NO2与水充分反应溶液中溶质的物质的量浓度计算技巧,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
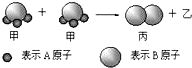
| A. | 根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 | |
| B. | Mr(甲)=Mr(乙)+Mr(丙) | |
| C. | 该反应一定属于氧化还原反应 | |
| D. | 该反应类型是分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H5CH2COOH | B. | C6H5COOH | C. | C6H13COOH | D. | C7H15COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | O2和O3互为同素异形体 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 干冰和冰为同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯分子都含有碳碳双键 |
| B | 乙酸乙酯和乙烯一定条件下都能和水反应 | 两者属于同一类型的反应 |
| C | 乙酸和葡萄糖都能与新制的氢氧化铜悬浊液反应 | 两者所含的官能团相同 |
| D | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 | 两者褪色的本质不相同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙烯生成乙醇属于加成反应 | B. | 2-甲基丁烷也称异丁烷 | ||
| C. | 油脂和蛋白质都属于高分子化合物 | D. | C4H9Cl有3种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
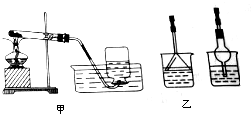 在实验室里用KClO3和MnO2的混合物加热制取少量的氧气,装置如图甲.实验结束后要先取出导气管,后撤走酒精灯,以防止水倒吸回试管的受热部分,引起试管的破裂.
在实验室里用KClO3和MnO2的混合物加热制取少量的氧气,装置如图甲.实验结束后要先取出导气管,后撤走酒精灯,以防止水倒吸回试管的受热部分,引起试管的破裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数大于4的一定是非金属元素 | |
| B. | 元素周期表有18纵列,7横行,故有18个族,7个周期 | |
| C. | 第ⅠA族就是碱金属 | |
| D. | 某ⅡA族元素的原子序数为a,则和其同周期ⅢA的元素的原子序数可能为a+11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
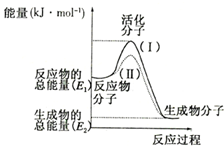 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mo1表示.请认真观察如图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mo1表示.请认真观察如图,然后回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com