
| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
分析 相同温度下饱和Na2CO3溶液的pH约为12,而所得废液的pH约为13,说明反应后溶质为NaOH和Na2CO3的混合液,
A.反应后溶质为NaOH和Na2CO3的混合液,则c(Na+)>c(OH-);
B.根据混合液中的电荷守恒判断;
C.稀释后溶质浓度减小,溶液中氢氧根离子浓度减小,溶液的pH减小;
D.碳酸根离子的水解为可逆反应,应该用可逆号.
解答 解:相同温度下饱和Na2CO3溶液的pH约为12,而所得废液的pH约为13,说明反应后溶质为NaOH和Na2CO3的混合液,
A.由于溶质为碳酸钠和氢氧化钠的混合物,则溶液中一定满足:c(Na+)>c(OH-),故A错误;
B.该溶液中一定满足电荷守恒:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-),故B正确;
C.该溶液为碱性溶液,稀释后溶液中氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.该溶液中氢氧化钠电离出氢氧根离子、碳酸根离子水解,溶液呈碱性,且碳酸根离子的水解应该用可逆号,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 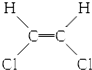 和 和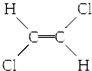 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S的电子式: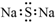 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: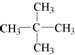 | |
| D. | 氯离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
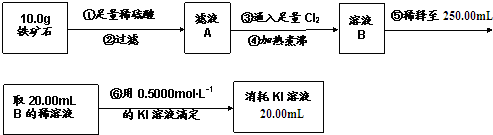
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
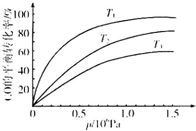 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com