
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式 。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字,NA取6.02×1023)。
Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理 。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg?L-1的废水,需用绿矾的质量为 kg。(写出主要计算过程)
(14分)Ⅰ.(1)O2+4e-+4H+=2H2O (2分) (2)阴极(1分);5.8×1023(2分)
Ⅱ.(1)FeS(s)+Cu2+(aq)=CuS(s) +Fe2+(aq) (2分)
(2)①Cr2O72-+6 Fe2++14H+=2Cr3++6 Fe3++7 H2O (2分) ②5(2分) ③125.1Kg (2分)
解析试题分析:Ⅰ.(1)氧气在反应中得到电子,所以在正极通入。又因为存在质子交换膜,所以通入氧气的电极反应式是O2+4e-+4H+=2H2O。
(2)惰性电极电解饱和食盐水,则阳极是氯离子失去电子,阴极是氢离子得到电子生成氢气。由于氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,则阴极周围出现红色。6.4g甲醇的物质的量是6.4g÷32g/mol=0.2mol,甲醇的氧化产物是CO2,反应中失去0.2mol×(4+2)=1.2mol。又因为电池的理论效率为80%,则外电路通过的电子个数为1.2mol×80%×6.02×1023/mol=5.8×1023。
Ⅱ.(1)根据溶度积常数可知,FeS的溶度积常数大于CuS的溶度积常数,所以FeS能转化为更难溶的CuS沉淀,反应的离子方程式为FeS(s)+Cu2+(aq)=CuS(s) +Fe2+(aq)。
(2)①反应中亚铁离子的氧化产物是铁离子,Cr2O72-的还原产物是Cr3+,所以根据电子得失守恒可知,该反应的离子方程式为Cr2O72-+6 Fe2++14H+=2Cr3++6 Fe3++7H2O。
②由于溶液中Cr3+浓度小于10-5mol/L时,可以视为完全沉淀,所以根据Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4可知,要使Cr3+沉淀完全,则溶液中c(OH-)= =10-9mol/L,所以pH=5。
=10-9mol/L,所以pH=5。
③根据反应的方程式可知
2Cr3+ ~ 6FeSO4·7H2O
2mol 6mol
78mg?L-1×100m3/52g? mol—1 n(FeSO4·7H2O)
解得n(FeSO4·7H2O)=450 mol
所以m(FeSO4·7H2O)=450 mol×278g? mol—1=125.1Kg
考点:考查电极反应式的书写、电极产物的判断和计算;溶解平衡以及溶度积常数和氧化还原反应的有关计算等


科目:高中化学 来源: 题型:填空题
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: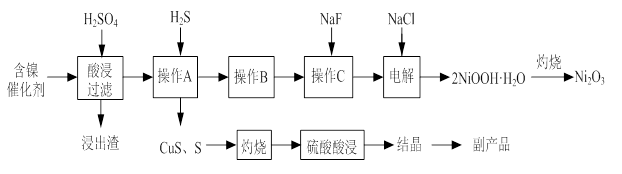
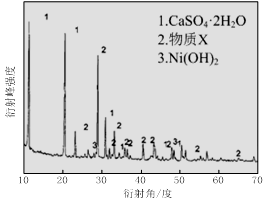
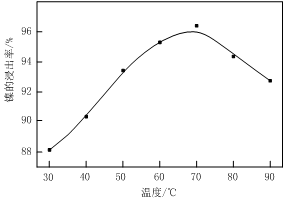
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、三人分别选用下列试剂进行实验:
0.1 mol·L-1醋酸溶液、pH=3的盐酸、pH=3的醋酸、、蒸馏水、锌粒、pH试纸等。
(1)甲取出10 mL0.1 mol·L-1醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是_________,理由是__________________________________。
(2)乙将pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,然后用pH试纸
分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是______________________________。
(3)丙分别取pH=3的盐酸和醋酸10 mL,然后分别加入质量相同的锌粒,醋酸放出H2的平均速率 (填“快”或“慢”),则认定醋酸是弱电解质,。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______?
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。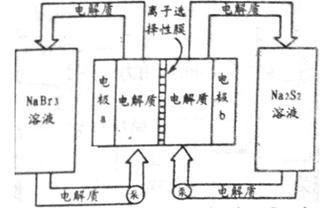
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与 关系如下表:
关系如下表:
 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: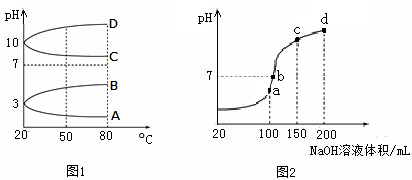
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH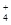 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH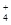 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)NH3在生活生产中用途广泛。
(1)下列关于NH3或氨水的实验能达到目的的是 (填编号)
| 编号 | A | B | C | D |
| 实验 装置 | 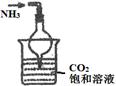 | 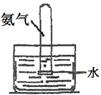 |  | 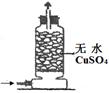 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |

| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com