
 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.分析 (1)①利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
②依据二氧化硫的性质:是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应.
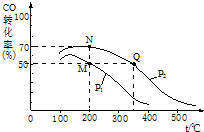
(2)①根据CO转化率计算参加反应的CO的物质的量,再根据方程式计算平衡时混合气体总物质的量变化量,进而计算平衡时混合气体总物质的量,据此解答;
②由图可知,一定压强下,温度越高,K越大;
(3)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,据此书写方程式.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)=H20 (g)△H=-241.8kJ•mol-1 ①
C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ•mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂;二氧化硫与氯化钙溶液不反应,且在亚硫酸氢钠溶液中的溶解度很小,所以不能用氯化钙和亚硫酸氢钠溶液做洗涤液,故答案为:ac;
(2)①A点CO的转化率为0.5,则参加反应的CO为10mol×0.5=5mol,则:
CO(g)+2H2(g)?CH3OH(g)气体物质的量减少
1 2
5mol 10mol
故A点平衡时,混合气体总的物质的量=10mol+20mol-10mol=20mol,
B点CO的转化率为0.7,则参加反应的CO为10mol×0.7=7mol,则:
CO(g)+2H2(g)?CH3OH(g)气体物质的量减少
1 2
7mol 14mol
故B点平衡时,混合气体总的物质的量=10mol+20mol-14mol=16mol
故A、B两点时容器内总气体的物质的量之比n(A):n(B)=20mol:16mol=5:4,
故答案为:5:4;
②由图可知,一定压强下,温度越高,CO的转化率越低,说明升高稳定平衡向逆反应方向移动,Q的温度高于N点,故平衡常数KM>KQ=KN,
故C答案为:KM=KN>KQ;
(3)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O,
故答案为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O.
点评 本题综合考查盖斯定律的应用、化学平衡图象,涉及化学平衡影响因素及有关计算、电化学和热化学的综合知识,注意知识的归纳和整理是关键,难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: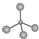 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: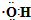 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷(As)位于周期表第4周期第ⅤA族 | B. | 气态氢化物稳定性:AsH3>PH3>NH3 | ||
| C. | 含氧酸酸性:H3AsO4>HNO3>H3PO4 | D. | 氢化物沸点:AsH3>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱NaOH,食盐NaCl | B. | 小苏打Na2CO3,苛性钠NaOH | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 胆矾CuSO4•5H2O,消石灰Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,用饱和食盐水与电石反应制乙炔 | |
| B. | 进行酸碱中和滴定时,锥形瓶应用待测液润洗 | |
| C. | 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 | |
| D. | 配制FeCl3溶液时,加入少量稀硫酸抑制其水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴水或酸性高锰酸钾溶液可以鉴别1-己烯和乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com