
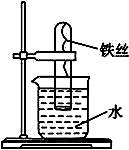
如图4-24所示,在大试管里放一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,将这个装置这样放置约一周后,观察到铁丝发生的变化是_____________________,原因是___________________________________。试管内水面会上升,最终上升高度大约为_______,原因是__________________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

图4-24
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点/℃ | 20.8 | 117.9 | 290 | 197.2 | 100 |

图6-24
请回答下列问题:
(1)试管A内在60—80 ℃时发生的主要反应的化学方程式为(注明反应条件)________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在____________;当试管A内主要反应完成后温度计水银球的位置应在___________,目的是___________________________________________________。
(3)烧杯B的作用是__________;烧杯B内盛装的液体可以是(写出一种即可)__________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

图1-4-23
加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如图1-4-24转化就可制取高聚物聚乙炔。
A中残留物①电石②乙炔③聚乙炔
![]()
图1-4-24
写出反应②③的化学方程式______________________、______________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有______种。
(3)锥形瓶C中观察到的现象_________________________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为___________。
(4)写出C中逸出的气体在工业上的两种用途___________、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com