
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛. ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝. .
. 分析 (1)溴元素的原子序数为35,原子结构中有4个电子层、最外层电子数为7;
(2)A.CCl4中碳和氯原子最外层满足8电子,XeF2分子中Xe最外层不是8e-结构;
B.Cl2O5对应的酸是氯酸,Cl2O7对应的是高氯酸;
C.氟非金属性强于氯,但氢氟酸的酸性弱于盐酸;
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强;
(3)氟化氢中氟原子和氢原子之间形成一对共用电子;因为二者的沸点差距较大;
(4)NaClO浓溶液中加入Al2(SO4)3溶液,发生双水解生成氢氧化铝白色沉淀和次氯酸,次氯酸会分解成氧气和盐酸;
(5)氯的最低价氧化物为一氧化二氯,氯元素化合价升高,所以有氯元素化合价降低到氯化钠,同时还有碳酸氢钠生成;
(6)向亚硫酸氢钠中滴加碘酸钾,发生反应为:3HSO3-+IO3-=3SO42-+I-+3H+,当亚硫酸氢根消耗完,再滴加碘酸钾,又发生反应为:IO3-+5I-+6H+=3I2+3H2O,所以一段时间后才有碘单质生成.
解答 解:(1)溴元素的原子序数为35,原子结构中有4个电子层、最外层电子数为7,则溴元素在第四周期第ⅦA族,故答案为:第四周期第ⅦA族;
(2)A.CCl4中碳和氯原子最外层满足8电子,XeF2分子中Xe最外层不是8e-结构,故A不选;
B.Cl2O5对应的酸是氯酸,Cl2O7对应的是高氯酸,二者都是酸性氧化物,故B选;
C.氟非金属性强于氯,但氢氟酸的酸性弱于盐酸,故C不选;
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强,故D选;
故答案为:BD;
(3)氟化氢中氟原子和氢原子之间形成一对共用电子,所以电子式为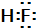 ;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,
;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,
故答案为: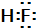 ;冷凝;
;冷凝;
(4)NaClO浓溶液中加入Al2(SO4)3溶液,发生双水解生成氢氧化铝白色沉淀和次氯酸,次氯酸会分解成氧气和盐酸,所以离子方程式为3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,次氯酸分解生成O2、HCl,
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;O2、HCl;
(5)氯的最低价氧化物为一氧化二氯,氯元素化合价升高,所以有氯元素化合价降低到氯化钠,同时还有碳酸氢钠生成,所以方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(6)向亚硫酸氢钠中滴加碘酸钾,发生反应为:3HSO3-+IO3-=3SO42-+I-+3H+,当亚硫酸氢根消耗完,再滴加碘酸钾,又发生反应为:IO3-+5I-+6H+=3I2+3H2O,所以一段时间后才有碘单质生成,则析出I2的物质的量与KIO3的物质的量之间关系的曲线为 ,
,
故答案为: .
.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度较大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X 的最高价氧化物对应的水化物酸性最强 | |
| B. | 化合物XY2、ZY2均能溶于水生成含氧酸 | |
| C. | Y的氢化物比W的氢化物沸点高 | |
| D. | 四种元素中W原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 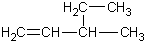 | ||
| C. | 2-甲基-2,4-己二烯 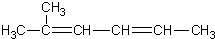 | D. | 2,2,3-三甲基戊烷 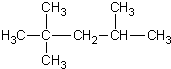 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
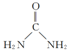 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3Cl2(g)+8NH3(g)═6NH4Cl(s)+N2(g)在常温下能自发进行,则该反应的△H<0 | |
| B. | 电解精炼铜时,电解液中CuSO4的物质的量浓度不变 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com