
分析 (1)原子利用率最高,力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%;
(2)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
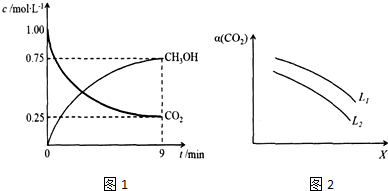
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率,依据反应速率之比等于化学方程式计量数之比得到氢气反应速率;
③反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,结合图象中二氧化碳转化率计算此时达到平衡放出的热量,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多;
④反应是气体体积减小的放热反应,升温平衡逆向进行,增大压强平衡正向进行,据此分析图象确定表示的物理量;
(3)①当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,
a、是某一时刻的特殊值,不能说明反应已达到平衡;
b、任意时刻该反应的压强都不变;不能说明反应已达到平衡;某一物质的浓度保持不变说明达到平衡;
c、浓度不变时为平衡的标志;
d、消耗速率得出CH3OH的正、逆反应速率相等,说明反应达到平衡;
②利用热化学方程式和盖斯定律计算所需热化学方程式,热化学方程式2a+b+c计算得到;
(4)根据燃料电池为燃料作负极失电子发生氧化反应,结合电解质溶液书写负极电极反应式;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据化合价升降相等配平.
解答 解:(1)a.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6,是自然界中实现的转化,原子利用率100%,但不是人工转化,故a不符合;
b.CO2=3H2$→_{△}^{催化剂}$CH3OH+H2O,反应中原子利用率不是100%,故b不符合;
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH,反应后原子利用率为100%,故c符合;
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2反应中原子利用率不是100%,故d不符合
故答案为:c;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=$\frac{0.75mol/L}{9min}$,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×$\frac{0.75mol/L}{9min}$=0.25mol/L•min,
故答案为:0.25mol/L•min;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2;温度一定时,增大压强,CO2平衡转化率增大;
(3)①a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd,
故答案为:cd;
②a、2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
b、2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
c、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:-246.4kJ•mol-1;
(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据氮元素化合价变化,配平反应的方程式,反应的化学方程式为:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2;
点评 本题考查化学平衡图象、化学平衡有关计算、化学平衡常数、影响化学平衡的因素、热化学方程式书写、电极反应式的书写等,是对知识的综合运用,难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
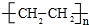 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
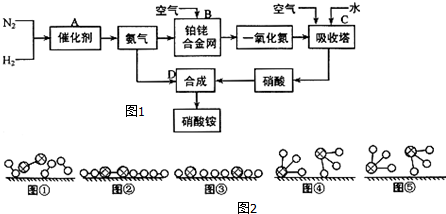
 、
、 、
、 分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
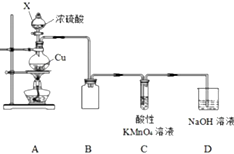 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
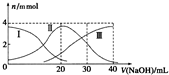 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
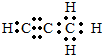 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com