
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s)B.υ(D)= 1 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(B)= 0.3 mol/(L·s)
【答案】D
【解析】
利用速率之比等于化学计量数之比转化为用 同一物质表示的速率,然后再进行比较;
都转化为D物质表示的速率进行比较,对于2A(g)+B(g)![]() 3C(g)+4D(g);
3C(g)+4D(g);
A.υ(A)= 0.5 mol/(L·s),速率之比等于化学计量数之比,故υ(D)=1 mol/(L·s);
B.υ(D)= 1 mol/(L·s);
C.υ(C)= 0.8 mol/(L·s),速率之比等于化学计量数之比,故υ(D)![]() 1.06 mol/(L·s);
1.06 mol/(L·s);
D.υ(B)= 0.3 mol/(L·s),速率之比等于化学计量数之比,故υ(D)=1.2 mol/(L·s);
结合以上分析可知,速率最快的为D;
故答案选D。


科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:

(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是

A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系,回答有关问题:

已知CH3CHO在一定条件下可被氧化为CH3COOH。
(1)A的结构简式为________,C试剂是________,砖红色沉淀是________(填化学式)。
(2)B溶液的作用是__________。
(3)④和⑥反应的化学方程式及反应类型分别为:
④_______, _______________。
⑥________, _________。
(4)由图示转化关系可知淀粉________(填“部分水解”或“完全水解”)。某同学取图中混合液E,加入碘水,溶液不变蓝色,________(填“能”或“不能”)说明淀粉水解完全,原因是__________。若向淀粉中加入少量硫酸,并加热使之发生水解,为检验淀粉水解的情况所需的试剂是________。(填序号)
①NaOH溶液 ②新制Cu(OH)2悬浊液 ③BaCl2溶液 ④碘水
(5)在进行蔗糖的水解实验并检验水解产物中是否含有葡萄糖时,某同学的操作如下:取少量纯蔗糖加水配成溶液,在蔗糖溶液中加入3~5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入新制Cu(OH)2悬浊液,加热,未见砖红色沉淀。其原因是________(填字母)。
a.蔗糖尚未水解
b.蔗糖水解的产物中没有葡萄糖
c.加热时间不够
d.煮沸后的溶液中没有加碱液无法中和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。

④含碳源中属于非极性分子的是______________(填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____
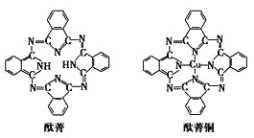
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学制作的燃料电池示意图如下,先闭合K1接通电源一段时间后,再断开K1、闭合K2 时,电流表指针偏转。下列分析正确的是
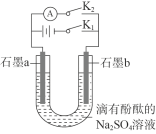
A.闭合K1时,Na2SO4开始电离
B.闭合K1时,石墨a 附近溶液逐渐变红
C.断开K1、闭合K2时,石墨a 附近溶液酸性逐渐减弱
D.断开K1、闭合K2时,石墨b极上发生反应:H22e-=2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得推论正确的是
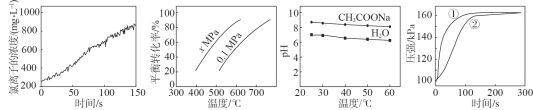
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2
B.乙是C4H10(g)![]() C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C.丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小
D.丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molHOOC—COOH含共用电子对数目为0.9NA
B.当1molKMnO4被还原时,强酸提供的H+数目为NA
C.pH=3的草酸溶液含有H+数目为0.001NA
D.该反应释放CO2分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com