

| ||


科目:高中化学 来源: 题型:
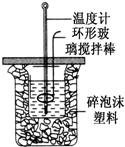 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.| 验验 编号 | 起始温度(℃) | 终止温度 (℃) | 温度差 (℃) | ||
| 盐酸 | 氢氧化钠 | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.4 | 24.8 | 24.65 | 27.8 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
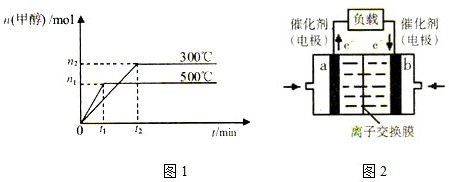
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
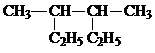 名称:
名称: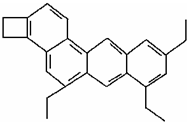
查看答案和解析>>
科目:高中化学 来源: 题型:
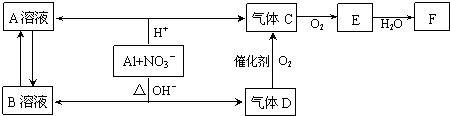
查看答案和解析>>
科目:高中化学 来源: 题型:
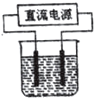 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com