
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)HClO
(4)Ⅰ.b c Ⅱ.小于(1分) 大于(1分)
(5)Al2O3+6H+= 2Al3++3H2O(2分)
解析试题分析:(1)同周期元素的原子随原子序数增大而半径减少(稀有气体突增),同主族元素的原子随原子序数增大而半径增大;
(2)同一周期越靠右,非金属性越强,同一主族越靠上,非金属越强,最高价氧化物对应水化物的酸性越强,则非金属性越强;
(3)次氯酸是一种强氧化剂;
(4)Ⅰ形成的氢化物越稳定,则其非金属性越强;最高价氧化物对应水化物的酸性越强,则非金属性越强;Ⅱ同周期元素的原子随原子序数增大而半径减少(稀有气体突增);
(5)氧化铝与硝酸反应生成硝酸铝和水。
考点:原子结构。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系: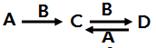
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题: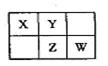
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3) AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是___ _。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是元素周期表的框架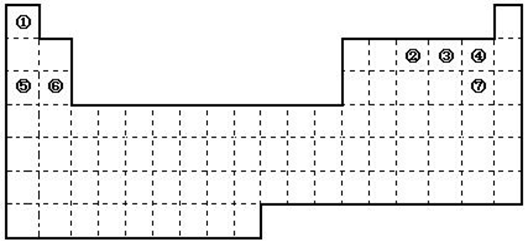
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________ 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________。将等体积、等浓度的W
的最高价氧化物对应的水化物和Y的氢化物混合,其化学方程式为__________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________________________________________________。
(4)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某短周期主族元素的原子M层上有一个半充满的亚层,这种原子的质子数是 ___________,写出它的外围电子排布图___________。
(2)VIA族的.硒(Se).在化合物中常表现出多种氧化态, H2SeO4比H2SeO3酸性_-___( 填强或弱),H2Se的酸性比H2S__________(填“强”或“弱”)。
(3)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_________,E离子的电子排布式为____________,C原子的电子排布图为 ,D原子的原子结构示意图为_______ 。
(2)B的氢化物的沸点高于同主族元素氢化物的沸点,原因是_____________,该氢化物的电子式为_______,中心原子的杂化方式为 _______,分子的立体构型为_______。
(3)DCA与E的最高价氧化物的水化物相互反应的离子方程式 。
(4)根据对角线规则,Be与E性质相似,写出Be与DCA溶液反应的离子方程式______________________
(5)若要说明非金属元素X比元素Y(X、Y均为非稀有气体元素)的非金属性强,则下列方法正确的是__________(填序号)。
①X单质可以把Y从其氢化物中置换出来
②X原子的最外层电子数比Y原子的最外层电子数多
③X的氧化物的水化物的酸性比Y的氧化物的水化物的酸性强
④与H2化合时X单质比Y单质容易
⑤电负性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
| | | A | |
| B | C | | D |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com