
【题目】通常状况下,![]() 、
、![]() 和
和![]() 是三种气态单质。
是三种气态单质。![]() 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);![]() 和
和![]() 均由元素
均由元素![]() 组成,
组成,![]() 能氧化
能氧化![]() ,反应的离子方程式为
,反应的离子方程式为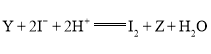 。
。
(1)写出物质的分子式:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)![]() 与
与![]() 的关系是______(填序号)。
的关系是______(填序号)。
a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中![]() 减少的主要物质是______。
减少的主要物质是______。
(4)将![]() 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
(5)举例说明![]() 的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
【答案】![]()
![]()
![]() c 氟氯烃(或氟利昂) 加热褪色后的溶液,若溶液恢复红色,则通入的气体为
c 氟氯烃(或氟利昂) 加热褪色后的溶液,若溶液恢复红色,则通入的气体为![]() ;若溶液不变红,则通入的气体是
;若溶液不变红,则通入的气体是![]()
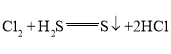 (其他合理答案也可)
(其他合理答案也可)
【解析】
通常状况下,X、Y和Z是三种气态单质,X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外),则X为Cl2;Y和Z均由元素R组成,反应Y+2I-+2H+═I2+Z+H2O常作为Y的鉴定反应,由元素守恒可知,Y、Z为O元素的同素异形体,R为O元素;可推知Y为O3、Z为O2;据此分析解答。
(1)根据上述分析,X、Y和Z的分子式分别为Cl2、O3、O2,故答案为:Cl2;O3;O2;
(2)Y为O3、Z为O2,都是由氧元素形成的结构不同的单质,二者互为同素异形体,故答案为:c;
(3)氟利昂能够破坏臭氧层,导致大气中![]() 减少,故答案为:氟氯烃(或氟利昂);
减少,故答案为:氟氯烃(或氟利昂);
(4)将O3和二氧化硫分别通入品红溶液,都能使品红褪色,由于臭氧具有强氧化性,褪色后的溶液不能恢复原来的颜色,二氧化硫是与有色物质结合生成无色不稳定的物质,加热后恢复原来的颜色,因此用褪色的溶液区别O3和二氧化硫的实验方法为:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3,故答案为:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3;
(5)氯气的氧化性比硫单质的氧化性强,能够将硫从硫化氢(或氢硫酸)中置换出来,反应的化学方程式为:H2S+Cl2═S+2HCl,故答案为:H2S+Cl2═S+2HCl。


科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
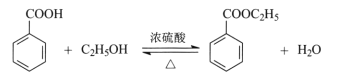
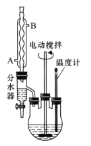
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点数据如表所示。
A组 | B组 | C组 | D组 |
金刚石:3550℃ |
|
|
|
硅晶体:1410℃ |
|
|
|
硼晶体:2300℃ |
|
|
|
二氧化硅:1723℃ |
|
|
|
请回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间的作用力是______。
(2)B组晶体共同的物理性质是______(填序号)。
A.有金属光泽 B.有导电性 C.有导热性 D.有延展性
(3)C组中酸性最弱的是______,最不稳定的是______。
(4)D组晶体可能具有的性质是______(填序号)。
A.硬度小 B.水溶液能导电 C.固体能导电 D.熔融状态下能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
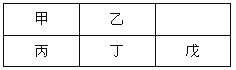
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
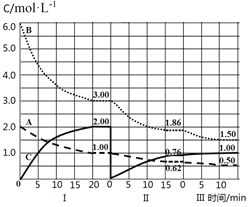
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
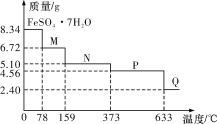
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时只得到一种无色气体生成
D.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com