
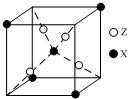
 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.分析 元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2,则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4,则Z为S元素.
(1)①同主族自上而下电负性减小;
②计算SO32-中S原子孤电子对数、价层电子对数,进而确定空间构型;
③原子数目相等、价电子总数也相等的微粒互为等电子体;
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能;
(3)①根据能量最低原理书写基态Fe2+的电子排布式;
②氨气分子中有3个σ键,CN-中含有1个σ键,形成6个配位键,也属于σ键;
(4)根据均摊法,晶胞中S、Fe原子数目,进而确定化学式.
解答 解:元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2,则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4,则Z为S元素.
(1)①同主族自上而下电负性减小,故电负性O>S,故答案为:O;
②离子SO32-中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,为三角锥形,故答案为:三角锥形;
③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,故答案为:SeO2;
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,
故答案为:H2O分子与乙醇分子间可形成氢键,而H2S不能;
(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6,故答案为:1s22s22p63s23p63d6;
②氨气分子中有3个σ键,CN-中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,故答案为:14mol;
(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4×$\frac{1}{8}$=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8,故答案为:Fe3S8.
点评 本题考查是对物质结构与性质的考查,涉及核外电子排布、电负性、空间构型判断、氢键、化学键、晶胞计算等,注重对基础知识的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ | B. | 945.6kJ | C. | 649kJ | D. | 869kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 共价化合物也能含有离子键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
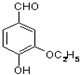 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.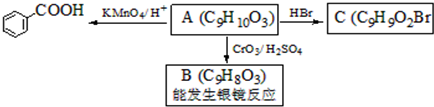
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.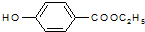 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用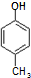 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).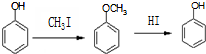
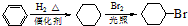
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com