
| A. | 石蕊试纸 | B. | PH试纸 | C. | KI淀粉试纸 | D. | 醋酸铅试纸 |
分析 A.石蕊试纸不可以检验气体酸碱性;
B.pH试纸测定溶液的酸碱性;
C.KI淀粉试纸检测有氧化性的物质;
D.醋酸铅试纸主要用于检验硫化氢气体的存在.
解答 解:A、根据干燥的红色石蕊试纸不可以检验气体酸碱性,因此红色石蕊试纸使用的第一步操作是:用蒸馏水润湿,故A错误;
B、pH试纸测定溶液的酸碱性,pH试纸用蒸馏水润湿后,相当于对原溶液进行稀释,则溶液的酸碱性会减弱,故B正确;
C、能使湿润的KI淀粉试纸变蓝的物质应具有氧化性,与KI反应生成单质碘,从而使淀粉变蓝,所以,在使用时预先能用蒸馏水润湿,故C错误;
D、根据干燥的蓝色石蕊试纸不可以检验气体酸碱性,因此蓝色石蕊试纸使用的第一步操作是:用蒸馏水润湿,故D错误.
故选B.
点评 本题考查了试纸的使用,对试纸使用方法的理解是解答的关键,较简单,学习中注意相关基础知识的积累.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
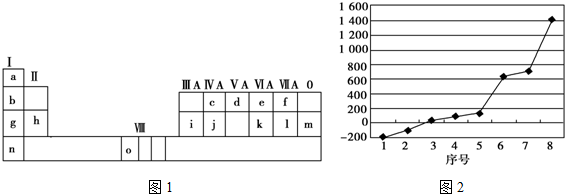
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为:B>A | |
| B. | D、E形成的简单离子的还原性:E>D | |
| C. | 气态氢化物的稳定性:D<C | |
| D. | 最高价氧化物对应的水化物的酸性:C>E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据图回答下列问题:
某烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据图回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,,固体甲与水的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑,0.5mol的固体甲与CO2反应转移的电子数目0.5NA.
,,固体甲与水的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑,0.5mol的固体甲与CO2反应转移的电子数目0.5NA.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com