
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
分析 (1)由图表数据分析,结合反应速率概念计算得到,v=$\frac{△c}{△t}$;
(2)当20-30min时,各物质的物质的量不变,则该反应达到平衡状态,K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(NO)}$;
(3)化学平衡时各组分的量不随时间的改变而改变,正逆反应速率相等;
(4)根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质;
(5)一定温度下,随着NO的起始浓度增大,相当于增大压强,平衡不移动.
解答 解:(1)10min~20min以v(CO2) 表示的反应速率=$\frac{0.30mol/L-0.21mol/L}{10min}$=0.009 mol•L-1•min-1,故答案为:0.009 mol•L-1•min-1;
(2)当20-30min时,各物质的物质的量不变,则该反应达到平衡状态,K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(NO)}$=$\frac{0.03×0.03}{0.0{4}^{2}}$=0.56,故答案为:0.56;
(3)A.两边的计量数相等,容器内压强始终保持不变,故A错误;
B.2v正(NO)=v逆(N2),速率之比不等于计量数之比,故B错误;
C.容器内CO2的体积分数不变,说明各物质的量不变,说明正逆反应速率相等,故C正确;
D.混合气体的密度保持不变,说明气体的质量不变,反应达平衡状态,故D正确;
故选:CD;
(4)根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质(减小CO2的浓度),
故答案为:分离出了二氧化碳(减小CO2的浓度);
(5)一定温度下,随着NO的起始浓度增大,相当于增大压强,平衡不移动,所以NO的平衡转化率不变,故答案为:不变.
点评 本题考查了化学平衡常数和反应速率概念计算应用,平衡标志的分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷是含碳量最低的碳氢化合物 | |
| B. | 所有的碳氢化合物分子组成均符合Cn H2n+2的通式 | |
| C. | 碳氢化合物一般都不溶于水 | |
| D. | 碳氢化合物分子中的化学键一定有极性键,也可能有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式:次氯酸: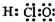 ;过氧化钠: ;过氧化钠: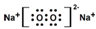 ;羟基: ;羟基: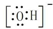 | |
| B. | KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化学式:聚异戊二烯: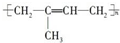 ;PVC: ;PVC: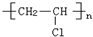 ;PE: ;PE: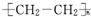 | |
| D. | 下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极精炼铜时,电解质溶液没有变化 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
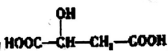 ,下列说法错误的是( )
,下列说法错误的是( )| A. | lmol苹果酸可与2 molNaOH发生中和反应 | |
| B. | 一定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | lmol苹果酸与足量金属Na反应生成1.5molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com