
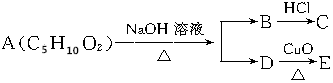
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 由反应转化关系可知A(C5H10O2)能在碱性条件下反应生成B和D,A应为酯,其中D能被氧化,则说明D为伯醇,符合条件的有CH3CH2CH2CH2OH和(CH3)2CHCH2OH,C能发生银镜反应,说明C为HCOOH,则B为HCOONa,以此解答该题.
解答 解:A(C5H10O2)能在碱性条件下反应生成B和D,A应为酯,其中D能被氧化,则说明D为伯醇,符合条件的有CH3CH2CH2CH2OH和(CH3)2CHCH2OH,C能发生银镜反应,说明C为HCOOH,则B为HCOONa,则A为HCOO(CH2)3CH3、(CH3)2CHCH2OOCH共2种,
故选B.
点评 本题考查有机物的推断,题目难度不大,本题注意题给信息,为解答该题的关键,特别是D→E,为易错点,答题时注意体会.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
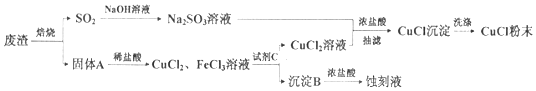
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 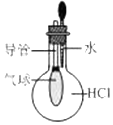 用装置验证 HCl 气体易溶于水 | |
| B. | 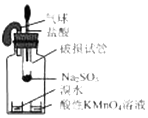 用装置验证 SO2具有漂白性 | |
| C. | 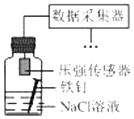 用装置采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 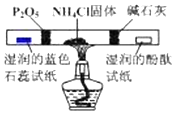 用装置检验 NH4Cl 分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 制备气体 | X(除杂试剂) | Y (检验试剂) | 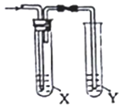 | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
| B | 电石与NaCl水溶液 | H2O | Br2的CCl4溶液 | |
| C | C2H5OH与浓硫酸 加热至170℃ | 饱和NaHSO3 溶液 | K2Cr2O7酸性溶液 | |
| D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com